Вычисление массовой доли нитрата натрия в тестовых задачах по химии
Иногда в тестах ЕГЭ встречаются задачи, в которых при расчете массы конечного раствора необходимо учитывать выпавшее в осадок вещество.
Задача 3.2.
К 1170 г 0,5%-ного раствора хлорида натрия прилили 1275 г 0,2%-ного раствора нитрата серебра. Какова массовая доля нитрата натрия в полученном растворе.
Дано:
масса раствора хлорида натрия: mр_ра(NаС1) = 1170 г;
массовая доля NаС1 в исходном р-ре:  (NаС1)в исх р-ре = 0,5% ;
(NаС1)в исх р-ре = 0,5% ;
масса раствора нитрата серебра: mр-ра(АgNО3) = 1275 г;
массовая доля АgNО3 в исходном р-ре:  (АgNО3)в исх.р-ре= 0,2% ;
(АgNО3)в исх.р-ре= 0,2% ;
Найти: массовую долю NaNО3 в конечном растворе:  (NaNО3)в кон..р-ре = ?
(NaNО3)в кон..р-ре = ?
Решение1:
При смешивании двух исходных растворов, растворенные вещества вступают между собой в реакцию обмена с образованием осадка:
NaCl + AgNO3 = NaNO3 + AgCl
Для наглядности все условие задачи удобно отобразить в виде рисунка:
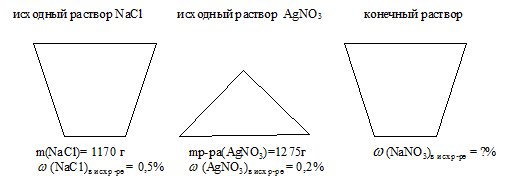
В условии указана информация, позволяющая определить количество вещества каждого из исходных участников реакции. Следовательно, сначала необходимо определить, какое вещество дано в недостатке, и далее по нему вести расчет. Кроме того, при определении массы конечного раствора следует учесть, что АgС1 выводиться из состава раствора в виде осадка.
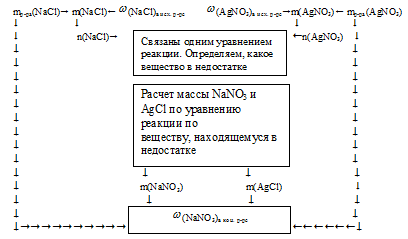
Алгоритм решения данной задачи можно отразить следующей схемой:
1. Находим массу и количество вещества NaС1 в первом исходном растворе:
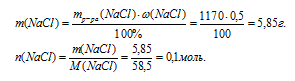
2. Находим массу и количество вещества AgNO3 во втором исходном растворе:
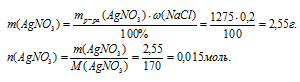
3. Находим, какое вещество дано в недостатке.
Выберем за основу хлорид натрия и определим по уравнению реакции количество АgNО3, которое необходимо для расходования 0,1 моль NаС1.
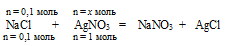
Составляем пропорцию:
на 0,1 моль NаС1 должно расходоваться х моль АgNО3 (по условию)
на 1 моль МаС1 полностью расходуется 1 моль
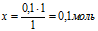 АgNО3 (по уравнению)АgNО3 необходимо для полного расходования всего NаС1.
АgNО3 (по уравнению)АgNО3 необходимо для полного расходования всего NаС1.
| n(АgNОз) необходимо | n(АgNОз) дано по условию |
| 0,1 моль > 0,015 моль | |
Нитрат серебра находится в недостатке и расходуется весь в процессе реакции. Поэтому дальнейшие расчеты по уравнению реакции будем проводить по количеству АgNО3.
4. По уравнению реакции, используя полученные значения количества вещества АgNО3, находим массу NaNО3 и АgС1:

5. Находим массовую долю NaNО3 в конечном растворе:
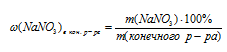
Масса раствора будет складываться из суммы масс исходных двух растворов, из которой вычтена масса осадка АgСl:
mкон. р-ра =
= mисх. р-ра(NaCl) + mисх. р-ра(AgNO3) – m(AgCl) =
= 1170 + 1275 – 2,15 = 2442,85 г.
Подставляем все данные в соотношение для массовой доли NaNО3:
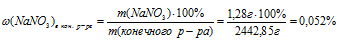
Ответ:  (NaNO3)в кон. р-ре = 0,052%.
(NaNO3)в кон. р-ре = 0,052%.

