Вычисление массовой доли хлорида железа III в тестовых задачах по химии
В некоторых задачах предполагается несколько химических реакций. Причем часто приходится определять избыток и недостаток в каждом из них.
Задача 3.3.
Хлор, выделившийся в результате взаимодействия 8,7 г оксида марганца (IV) с 120 мл 30% соляной кислоты (р = = 1,16 г/мл), вступил в реакцию с железом массой 2,8 г. Образовавшуюся соль растворили в 100 г воды. Определите массовую долю соли в полученном растворе.
Дано:
масса оксида марганца (IV): m(МпО2) = 8,7 г;
объем соляной кислоты: Vр-ра(НСl) = 120 мл;
массовая доля НС1 в соляной кислоте:  (НСl) = 30%
(НСl) = 30%
плотность соляной кислоты: рр-ра(НСl) = 1,16 г/мл;
масса железа: m(Fе) = 2,8 г;
масса воды: m(Н2О) = 100 г.
Найти: массовую долю соли в конечном растворе.
Решение:
В условии задачи описано несколько последовательных химических реакций.
1. Окисление хлора из НСl оксидом марганца (IV):
МnO2 + 4НСl = МпСl2 + Сl2 + 2Н2О.
2. Образовавшийся в первой реакции газообразный хлор выводится из исходного раствора и направляется в другую реакционную емкость для взаимодействия с металлическим железом. При этом следует учитывать, что оно окисляется до степени окисления (+3).
ЗСl2 + 2Fe = 2FeСl3.
Хлорид железа (III), полученный во второй реакции, растворяют в воде. В результате получается новый раствор, в котором необходимо определить массовую долю растворенной соли.
В данной задаче определение избытка-недостатка нам придется проводить дважды: для первого и для второго уравнений. Алгоритм решения можно представить следующей схемой:
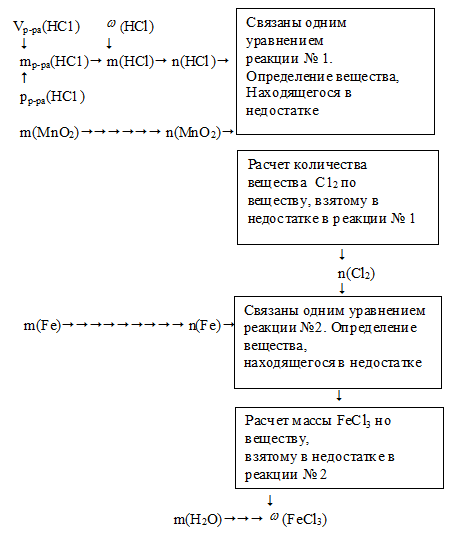
1. Находим массу соляной кислоты и массу НСl в ней:
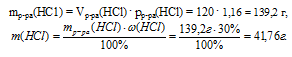
2. Находим количество вещества НС1 и МпО2, принявших участие в первой реакции:
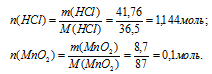
3. Определяем, какое вещество находится в недостатке в первой реакции.
Выберем за основу оксид марганца (IV) и определим по уравнению реакции количество НС1, которое необходимо для расходования 0,1моль MnO2.
n= 0,1 моль n = х молъ
МnО2 + 4НСl = МnСl2 + С12 + 2Н2О.
n = 1 моль n = 4 моль
Составляем пропорцию:
на 0,1 моль МnО2 должно расходоваться х моль НСl (по условию)
на 1 моль МnО2 полностью расходуется 4 моль НСl (по уравнению)
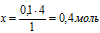 НС1 необходимо для полного расходования всего МnО2.
НС1 необходимо для полного расходования всего МnО2.
| n(HCl) необходимо | n(HCl) дано по условию |
| 0,4 моль < 1,144 моль | |
НС1 находится в избытке и расходуется не весь в процессе реакции. Поэтому дальнейшие расчеты по уравнению реакции будем проводить по МnО2, так как он в недостатке и расходуется весь.
4. По количеству МnО2 рассчитываем количество вещества С12, выделившегося в 1 реакции:
n= 0,1 моль n = х молъ
МnО2 + 4НСl = МnСl2 + Сl2 + 2Н2О.
n = 1 моль n = 4 моль
Составляем пропорцию:
0,1 моль МnО2 дает х моль Сl2 (по условию);
1 моль МnО2 дает 1 моль Сl2 (по уравнению);
х =0,1 . 1/0,1 = 0,1 моль = n(Сl2).
5. По условию весь хлор, выделившийся в 1 реакции, вступил во взаимодействие с железом. Находим количество вещества железа, данное по условию:
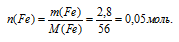
6. Определяем, какое вещество находится в недостатке во второй реакции.
Выберем за основу хлор и определим по уравнению реакции количество Fе, которое необходимо для расходования 0,1 моль С12.
n = 0,1 моль n — х моль
3Сl2 + 2Fе = 2FеСl3
п = 3 моль n = 2 моль
Составляем пропорцию:
на 0,1 моль Сl2 должно расходоваться х моль Fe (по усл.);
на 3 моль Сl2 полностью расходуется 2 моль Fe (по уравн.);
х = 0,1 . 0,2/ 3 = 0,667 моль Fе необходимо для полного расходования всего С12.
| n(Fe) необходимо | n(Fe) дано по условию |
| 0,667 моль > 0,05 моль | |
Железо находится в недостатке и расходуется полностью в процессе реакции. Поэтому дальнейшие расчеты по уравнению реакции будем проводить по нему.
7. По количеству вещества железа, определяем массу образовавшейся во второй реакции соли:
n = 0,05 моль m = х г
3Сl2 + 2Fе = 2FeСl3
n = 2 моль n = 2 моль
М= 162,5 г/моль
m = 325 г
Составляем пропорцию:
0,05 моль Fе дают x г FеСl3 (по условию);
2 моль Fе дают 325 г FеСl3 (по уравнению);
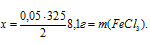
8. Определяем массовую долю FeCl3, после растворения его в 100 г воды:
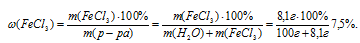
Ответ:  (FeCl3) = 7,5%.
(FeCl3) = 7,5%.
Задачи на вычисление массовой доли вещества:
1. Массовая доля фосфорной кислоты
2. Массовая доля бензойной кислоты
3. Массовая доля глюкозы

