"Химия. 11 класс". О.С. Габриелян (гдз)
Графические электронные формулы атомов элементов
Вопрос 1.
Принцип Паули гласит, что на одной орбитали одновременно могут находиться только 2 электрона, причём с противоположными спинами. Этот принцип лежит в основе образования химической связи, потому, что если он не будет соблюдаться, то не будут образовываться химические связи и соединения, так как при этом атомы будут соединяться и мгновенно снова распадаться.
Вопрос 2.
Правило Хунда гласит, что суммарный спин атома должен быть максимален, т. е. сначала все свободные орбитали заполняются по одному электрону, а потом по второму. Если бы это правило не соблюдалось, то невозможно было бы образование сложной химической связи, ведь почти все электроны были бы уже спаренными.
Вопрос 3.
Для упрощения графических электронных формул атомов обозначим условно графическую электронную формулу атома аргона (Аr) и не будем изображать подуровни, которые у этих атомов заполняются.
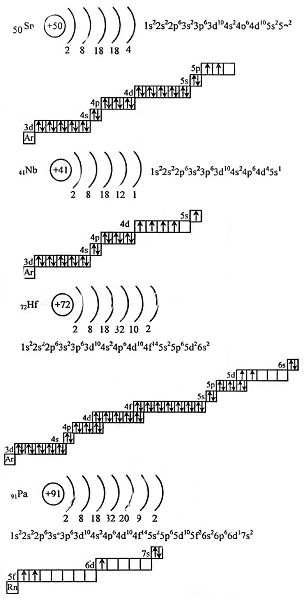
Вопрос 4.
Существующим инертным газом для элемента № 110 является
радон +86Rn.
Графическая формула имеет вид:
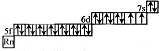
Вопрос 5.
"Провал" электрона — переход электрона с внешнего энергетического уровня на более низкий, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций. Подобное явление наблюдается у меди и хрома:
+24Сг 1s22s22p63s23p63d54s1
+29Cu 1s22s22p63s23p63d104s1
Вопрос 6.
Принадлежность элемента к конкретному электронному семейству определяется порядком заполнения подуровней электронами.
Вопрос 7.
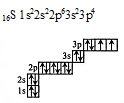
Графические электронные формулы атомов показывают, что электроны более «старших» энергетических уровней обладают большей энергией, а также различна энергия разных подуровней.

