Метод определения формулы неорганической соли
Приводится пример решения задачи, которая содержит две интересные особенности. Во-первых, основываясь на знаниях химических свойств веществ, требуется определить состав исходной соли. Во-вторых, необходимо учесть тот факт, что запись найденной формулы должна быть согласована с химическим смыслом.
Задача 2.10.
При прокаливании соли массой 12,8 г получили 7,2 г воды и 4,48 л (н.у.) бесцветного газа, который при обычных условиях реагирует только с литием и имеет относительную плотность по метану 1,75. Определите формулу соли.
Дано:
масса соли: m(соли) = 12,8 г;
масса воды: m(Н2О) = 7,2 г;
объем бесцветного газа (н.у.): V(газа) = 4,48 л;
относительная плотность газа по метану: D(СН4)= 1,75.
Найти: формулу исходной соли.
Решение:
Шаг 1. При прокаливании соли, очевидно, шла реакция разложения. Следовательно, в состав исходной соли входил водород и кислород. Для установления третьего элемента, образующего бесцветный газ определим его молярную массу:
М(неизвестного газа) = D(СН4) . М(СН4) =
= 1,75 . 16 = 28 г/моль.
Такое небольшое значение молярной массы значительно сокращает круг поиска. Кроме того, указание на низкую химическую активность газа позволяет предположить, что это — азот (N2). Предположение подтверждается возможностью химической реакции между азотом и литием при обычных условиях.
Обозначим формулу неизвестного вещества как НxOy Nz.
Шаг 2. В условии описана химическая реакция разложения исходной соли. Запишем ее схему:
НxOy Nz ---> Н2О + N2.
Шаг 3. По данным о продуктах разложения находим количество вещества атомов каждого из элементов в образце исходной соли.
а) определение количества вещества атомов азота:
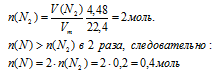
б) определение количества вещества атомов водорода и кислорода будем вести по алгоритму:
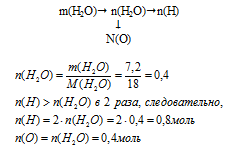
Записываем соотношение количеств веществ атомов:
n(Н) : n(О) : n(N) = 0,8 : 0,4 : 0,4.
Шаг 4. Находим простейшую формулу:
N(H):N(O):N(N) = 0,8 : 0,4 : 0,4.
Выбираем наименьшее значение (в данном случае 0,4) и делим на него все 3 числа.
N(Н) : N(О) : N(N)= 2 : 1 : 1.
Получили набор наименьших целых чисел. Это позволяет нам записать простейшую формулу: Н2O1N1.
Шаг 5. Выявление истинной формулы.
Такая запись формулы не отражает химической сути вещества. Более того, по элементному составу невозможно однозначно отнести это вещество к какому-либо классу. С таким
элементным составом наиболее известны азотная (НNO3) и азотистая (HNO2) кислоты. Но в обоих случаях соотношение азота и водорода в формуле 1 : 1. В нашем же случае соотношение азота и водорода — 1 : 2 . Такому же элементному составу соответствуют аммонийные соли этих кислот. Нитрат аммония (NH4NO3) и нитрит аммония (NH4NO2). Соотношению атомов в простейшей формуле соответствует истинная формула — (NH4NO2). В ней для придания химического смысла количество атомов удвоено по сравнению с простейшей формулой. Из записи (NH4NO2) видно, что искомое вещество – соль, состоящая из иона аммония (NН4)+ и кислотного остатка азотистой кислоты (NO2)–
Ответ: NH4NO2.
Большинство задач, в которых индексы в истинной формуле в несколько раз больше, чем в простейшей, содержат информацию об истинной молярной массе искомого вещества.
Она может быть выражена как напрямую, так и косвенно. Наиболее распространены данные об относительной плотности паров искомого вещества по известному газу. Но в некоторых
задачах тестов ЕГЭ такие данные отсутствуют, и необходимо путем комбинации атомов и увеличения индексов придать формуле химический смысл. В последней задаче наиболее рас-
распространенной ошибкой было отсутствие истинной формулы соли. В качестве ответа записывали простейшую формулу. Такая же ошибка присутствовала при решении задач с галогеналканами. Полученную простейшую формулу СН2F или СН2С1 в неизменном виде записывали в ответ, несмотря на то, что в данной записи валентность у углерода меньше 4.
В таких задачах разумно составлять структурную формулу и убедиться в реальном существовании вещества. Так в задачах с галогеналканами необходимо было индексы в СН2F или СН2С1 увеличивать в 2 раза и дигалогенэтан записать в виде ответа.
Комментарии:
1 Указанная в условии масса исходной соли не используется ни в данном варианте решения, ни в инструкции для проверяющих. Лишние, избыточные данные иногда встречаются в задачах тестов ЕГЭ.

