Расчёты по химическим формулам и уравнениям реакций
Задача 130.
Из навески чугунных стружек массой 3,4260 г после соответствующей обработки получили 0,0998 г SiO2. Вычислить процентное содержание (по массе) кремния в анализируемом чугуне.
Решение:
Мольные массы кремния, оксида кремния равны соответственно 28,086 и 60,086г/моль. Рассчитаем массу кремния, затраченного на образование оксида кремния из пропорции:
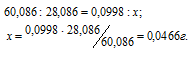
Процентное содержание кремния (по массе) в анализируемом образце можно вычислить по формуле:
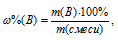
Где  - массовая доля вещества (В) в процентах, %; m(B) - масса вещества (В) в образце, г; m(обр.) - масса анализируемого образца, г.
- массовая доля вещества (В) в процентах, %; m(B) - масса вещества (В) в образце, г; m(обр.) - масса анализируемого образца, г.
Тогда
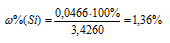
Ответ: 1,36%.
Задача 131.
Какой объем водорода (условия нормальные) надо затратить для восстановления 125 г МоО3 до металла?
Решение:
Уравнение протекающей реакции:
МоО3 + 3Н2 = Мо + 3Н2О
Мольная масса МоО3 равна 143,94 г/моль. Мольный объём газа равен 22,4 л/моль. Согласно уравнению реакции 3 моль водорода восстанавливают 1 моль оксида молибдена. Рассчитаем объём водорода, затраченный на восстановление 125 г оксида молибдена из пропорции:
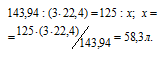
Ответ: 58,3 л.
Задача 132.
При взаимодействии соляной кислоты с 1,20 г сплава магния с алюминием выделилось 1,42 л водорода, измеренного при 23 °С и давлении 100,7 кПа. Вычислить процентный состав сплава (по массе).
Решение:
Мольные массы Mg и Al соответственно равны 24,312 и 26,98 г/моль. Мольный объём газа равен 22,4 л/моль.
Найдём. Какой объём займёт 1,24 л Н2 при нормальных условиях (Р = 101,325 кПа и Т = 273 К), используя уравнение объединённого газового закона:
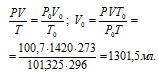
Уравнение протекающей реакции:
Mg + 2HCl = MgCl2 + H2↑;
2Al + 6HCl = 2AlCl3 + 3H2↑./p>
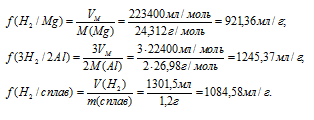
Далее составляем диагональную схему. При составлении такой схемы необходимо учитывать следующее: если значение свойства смеси больше значения свойства какого-то компонента, берут разность значений свойств смеси и этого компонента; наоборот, при большем значении свойства какого-то компонента берут разность значений свойств компонента и смеси. В соответствии с этими правилами диагональная схема для данной задачи будет иметь вид:

Делая массу смеси пропорционально числам отношения, получим значения масс магния и алюминия в смеси:
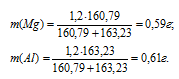
Процентное содержание магния и алюминия (по массе) в анализируемом образце можно вычислить по формуле:
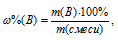
Где
 - массовая доля вещества (В) в процентах, %; m(B) - масса вещества (В) в образце, г; m(обр.) - масса анализируемого образца, г.
- массовая доля вещества (В) в процентах, %; m(B) - масса вещества (В) в образце, г; m(обр.) - масса анализируемого образца, г.
Тогда
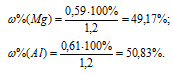
Ответ: 49,17% Mg; 50,83% Al.
Задача 133.
Для определения содержания NaСl в техническом NaNO3 2,00 г последнего растворили в воде и к полученному раствору добавили в избытке раствор AgNO3. Полученный осадок промыли и высушили. Масса осадка оказалась равной 0,287 г. Найти массу NaСl, содержавшегося в исходном образце.
Решение:
Мольные массы AgNO3 и AgCl соответственно равны 58,543 и 143,321 г/моль. AgNO3 осаждает ионы Cl– из раствора в виде осадка нерастворимой соли AgCl. Реакция протекает по схеме:
AgNO3 + NaCl = AgCl↓ + NaNO3
Согласно уравнению реакции 1 моль NaCl образует 1 моль AgCl. Рассчитаем массу NaCl, содержащегося в исходном образце из пропорции:
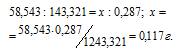
Ответ: 0,117 г.
Задача 134.
Простейшая формула гидразина NH2. Какова его истинная формула, если плотность пара гидразина по воздуху равна 1,1: а) NH2; б) N2H4; в) N3H6?
Решение:
Истинную молекулярную массу гидразина находим исходя из его плотности по воздуху:
M(NxHy) = D(Возд.) . 29 = 1,1 . 29 = 32 г/моль,
где 29 – молекулярная масса воздуха.
Так как простейшая формула вещества NH2, то этой формуле отвечает молекулярная масса, равная 16. Вычислим множитель (n), на который следует умножить значения всех членов в простейшей формуле, разделив значение M(NxHy) на значение M(NH2):
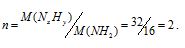
Теперь значения индексов в простейшей формуле умножим на 2, получим: 2 . NH2 = N2H4. Таким образом, истинная формула гидразина имеет вид: N2H4.
Ответ: б).
Задача 135.
Простейшая формула соединения углерода с водородом СН2. Какова истинная формула соединения, если масса 1 л газа равна массе 1 л азота: а) С3Н6; б) С2Н4; в) С4Н8?
Решение:
Мольный объём любого газа равен 22,4 л/моль. Мольная масса N2 равна 28 г/моль. Следовательно, мольная масса соединения CxHy равна тоже 28г/моль. Простейшая формула соединения СН2. Этой формуле соответствует молекулярная масса равная 28. Вычислим множитель (n), на который следует умножить значения всех членов в простейшей формуле, разделив значение M(CxHy) на значение CH2:
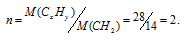
Теперь значения индексов в простейшей формуле умножим на 2, получим: 2 . CH2 = С2H4. Таким образом, истинная формула гидразина имеет вид: С2H4.
Ответ: б).
Задача 136.
Какова молекулярная формула соединения азота с кислородом, если плотность этого газа по водороду равна 15: а) NО; б) N2О; в) NO2?
Решение:
Истинная молекулярная масса вещества может быть вычислена по формуле:
M(B) = D . M(H2)
Тогда
M(NxOy) = 15 . 2 = 30 г/моль.
Данной молекулярной массе отвечает формула оксида азота NO:
[M(NxOy) = x + y = 30;
x = 30 – y = 30 – 16 = 14].
Ответ: а).
Задача 137.
Металл вытеснил из кислоты 16,8 мл Н2 (условия нормальные). Какой объем N2 необходим для связывания этого количества водорода в NH3: а) 11,2 мл; 6) 5,6 мл; в) 8, мл?
Решение:
Уравнение реакции имеет вид:
N2 + 3H2 = 2NH3
1 моль любого газа при нормальных условиях занимает объём 22,4 л. Согласно уравнению реакции 1 моль (22,4 л) N2 связывается с 3 моль (67,2л) Н2, образуя 2 моль NH3. Рассчитаем объём азота, необходимый для связывания водорода из пропорции:
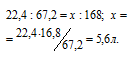
Ответ: б).
Задача 138.
При разложении СаСО3 выделилось 11,2л СО2. Чему равна масса КОН, необходимая для связывания выделившегося газа в карбонат: а) 56 г; 6) 112 г; в) 28 г?
Решение:
Уравнение протекающей реакции:
2KOH + CO2 = K2CO3 + H2O
1 моль любого газа при нормальных условиях занимает объём 22,4 л. Молекулярная масса КОН равна 56 г/моль. Согласно уравнению реакции 1 моль СО2 связывает 2 моль КОН в К2СО3. Рассчитаем массу КОН, необходимую для связывания выделившегося углекислого газа в карбонат из пропорции:
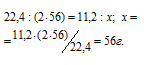
Ответ: 56 г.
Задача 139.
Определить реакцию среды в растворе после взаимодействия 90 г NаОН с 73 г НСI: а) нейтральная; б) кислая; в) щелочная.
Решение:
Уравнение протекающей реакции:
NaOH + HCl = NaC + H2O
Мольные массы NaOH и HCl соответственно равны 40 и 36,453 г/моль. Находим количества взятых для реакции NaOH и HCl:
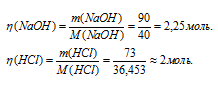
Согласно уравнению реакции 1 моль NaOH реагирует с 1 моль HCl. В избытке взят раствор NaOH так как 2,25 > 2. При диссоциации избытка NaOH образуется дополнительное количество ионов OH-:
NaOH ⇔ Na+ + OH-
Избыточное количество гидроксид-ионов OH- придаёт раствору щелочную реакцию (РН > 7).
Ответ: в).

