Расчёты, связанные с протеканием химических реакций
Задача 121.
Смешано 7,3 г НСl с 4,0г NH3. Сколько граммов NH4Сl образуется? Найти массу оставшегося после реакции газа.
Решение:
Уравнение реакции имеет вид:
NH3 + HCl = NH4Cl
Молекулярные массы HCl, NH3 и NH4Cl соответственно равны 36,453, 17 и 53,453. Следовательно, их мольные массы составляют 36,453; 17; 53,453г/моль. Согласно уравнению реакции 1 моль HCl реагирует с 1 моль NH3, образуя 1 моль NH4Cl. Находим, какое вещество взято в недостатке:
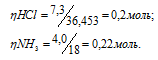
В недостатке взято 0,2 моля HCl, значит, расчёт массы, образовавшейся соли NH4Cl, производим по количеству соляной кислоты:
m(NH4Cl) = 0,2. 53,453 = 10,69г.
Затем рассчитаем массу NH3, вступившего в реакцию с HCl:
m(NH3) = 0,2. 17 = 3,4г.
Ответ: 10,69 г NH4Cl; 3,4 г NH3.
Задача 122.
Какой объем воздуха потребуется для сжигания 1м3 газа, имеющего следующий состав по объему: 50% Н2, 35% СН4, 8% СО, 2% С2Н4 и 5% негорючих примесей. Объемное содержание кислорода в воздухе равно 21%.
Решение:
Рассчитаем объём кислорода, необходимый для сжигания газов.
а) Уравнение реакции сгорания водорода:
2Н2 + О2 = 2Н2О
Находим объём водорода, содержащегося в 1 м3 газа из пропорции:
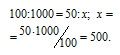
Согласно уравнению реакции на сжигание 2 молей Н2 расходуется 1 моль О2 т.е. на сжигание 44,8 л водорода требуется 22,4 л кислорода.
Находим объём расходуемого кислорода из пропорции:
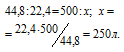
б) Уравнение реакции сгорания метана:
СН4 + О2 = СО2 + 2Н2О
Находим объём метана, содержащегося в 1 м3 газа из пропорции:
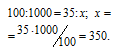
Согласно уравнению реакции на сжигание 1 моль СН4 расходуется 2 моля О2 т.е. на сжигание 22,4 л метана требуется 44,8л кислорода.
Находим объём расходуемого кислорода из пропорции:
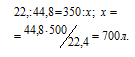
в) Уравнение реакции горения угарного газа:
2CO + O2 = 2CO2
Находим объём угарного газа, содержащегося в 1м3 газа из пропорции:
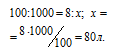
Согласно уравнению реакции на сжигание 2 молей СО расходуется 1 моль О2 т.е. на сжигание 44,8 л угарного газа требуется 22,4 л кислорода.
Находим объём расходуемого кислорода из пропорции:
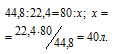
г) Уравнение реакции горения этилена:
C2H4 + 3O2 = 2CO2 + 2H2O
Согласно уравнению реакции на сжигание 1 моль С2Н4 расходуется 3 моль О2, т.е. затрачивается в три раз больший объём кислорода, чем этилена.
Находим содержание этилена в 1 м3 газа из пропорции:
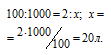
Кислорода для сжигания этилена требуется в три раза больше по объёму, чем этилена, а именно 60 л (20 . 3 = 60).
Теперь находим общий объём кислорода, затраченный на сжигание 1 м3 газа:
V(O2) = 250 + 700 + 40 + 60 = 1050 л.
Рассчитаем объём воздуха, содержащий 1050 л кислорода из пропорции
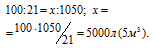
Ответ: 5 м3
Задача 123.
При пропускании водяного пара над раскаленным углем получается водяной газ, состоящий из равных объемов СО и Н2. Какой объем водяного газа (условия нормальные) может быть получен из 3,0 кг угля?
Решение:
Уравнение протекающей реакции:
C(к) + H2О(г) = СО(г) + Н2(г)
Согласно уравнению реакции из одного моля угля и одного моля воды образуется «водяной газ», состоящий из одного моля угарного газа и одного моля водорода. Мольная масса углерода равна 12 кг/кмоль; 1 кмолоь «водяного газа» занимает объём 44,8 м3.
Рассчитаем объём водяного газа, образуемого из 3 кг угля из пропорции:
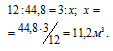
Ответ: 11,2 м3.
Задача 124.
Карбонат кальция разлагается при нагревании на СаО и СО2. Какая масса природного известняка, содержащего 90% (масс.) СаСО3, потребуется для получения 7,0т негашеной извести?
Решение:
Уравнение протекающей реакции:
СаСO3  CaO + CO2
CaO + CO2
Молекулярные массы СаСО3 и СаО соответственно равны 100 и 56, следовательно, их мольные массы составляют 100 и 56 г/моль. Согласно уравнению реакции 1 моль СаСО3 образует 1 моль СаО. Находим теоретический выход негашёной извести из пропорции:
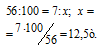
Находим массу природного известняка из пропорции:
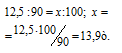
Ответ: 13,9 т.
Задача 125.
К раствору, содержащему 6,8 г АIСl3, прилили раствор, содержащий 5,0 г КОН. Найти массу образовавшегося осадка.
Решение:
Уравнение протекающей реакции:
АIСl3 + 3КОН = Al(OH)3↓ + 3H2O
Мольные массы АlCl3, KOH и Al(OH)3 соответственно равны 133,34; 56 и 78 г/моль. Рассчитаем количество реагирующих веществ по формуле:
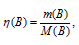
Где
n - количество вещества, моль; m(B) – масса вещества, г; M(B) – мольная масса, г/моль.
Отсюда
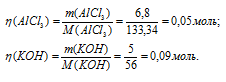
Согласно уравнению реакции 1 моль AlCl3 реагирует с 3 моль КОН с образованием 1 моль Al(OH)3, т.е. КОН должно 0,15 моль (0,05 . 3 = 0,15), чем взято по условию задачи (0,09 моль). Таким образом, КОН взят в недостатке, поэтому расчёт массы Al(OH)3 проводим по КОН, получим:
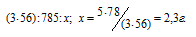
Ответ: 2,3 г
Задача 126.
Через раствор, содержащий 7,4г гидроксида кальция, пропустили 3,36л диоксида углерода, взятого при нормальных условиях. Найти массу вещества, образовавшегося в результате реакции.
Решение:
Уравнение реакции имеет вид:
Ca(OH)2 + CO2 = CaCO3↓ + H2O
Молекулярные массы Са(ОН)2 и СаСО3 соответственно равны 74 и 100, следовательно, их мольные массы составляют 74 и 100г/моль. Согласно уравнению реакции из 1 моль Са(ОН)2 и 1 моль СО2 образуется 1 моль СаСО3. Рассчитаем количество реагирующих веществ по формуле
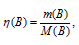
Где
n - количество вещества, моль; m(B) – масса вещества, г; M(B) – мольная масса, г/моль.
Отсюда
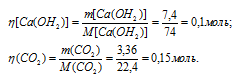
Следовательно, СО2 взят в избытке и поэтому расчёт массы образовавшегося СаСО3 будем проводить по Са(ОН)2.
Тогда
m(CaCO3) = n(CaCO3) . M(CaCO3) = 0,1 . 100 = 10 г.
Ответ: 10 г.
Задача 127.
Рассчитать массу кристаллогидрата Cu(NO3) . 3Н2O, полученного растворением 10 г меди в азотной кислоте и последующим выпариванием раствора.
Решение:
Уравнение протекающей реакции:
3Сu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
Мольные массы Cu и Cu(NO3)2 соответственно равны 63,55 и 187,55 г/моль. Согласно уравнению реакции из 3 моль Cu образуется 3 моль Cu(NO3)2. Рассчитаем массу Cu(NO3)2, образующуюся при растворении 10 г меди в азотной кислоте:
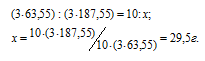
Находим мольную массу кристаллогидрата нитрата меди:
M[(Cu(NO3)2) . 3H2O] = 187,55 + (3 . 18) = 214,55г/моль.
Рассчитаем массу образовавшегося кристаллогидрата меди:
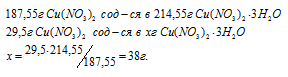
Ответ: 38 г
Задача 128.
При обработке раствором гидроксида натрия 3,90г смеси алюминия с его оксидом выделялось 840 мл газа, измеренного при нормальных условиях. Определить процентный состав (по массе) исходной смеси.
Решение:
Уравнения протекающих реакций:
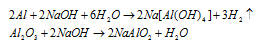
Следовательно, водород образуется при растворении алюминия в растворе щёлочи Согласно уравнению реакции из 2 моль Al (2 . 27 = 54 г) образуется 3 моль Н2 или 67,2л (3 . 22,4 = 67,2). Рассчитаем массу алюминия в смеси из пропорции:
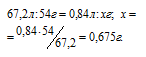
Теперь находим процентное содержание алюминия в смеси по формуле:
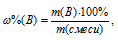
Где
 (B) - массовая доля вещества (В) в процентах, %; m(B) - масса вещества (В) в смеси, г; m(смеси) - масса смеси веществ, г.
(B) - массовая доля вещества (В) в процентах, %; m(B) - масса вещества (В) в смеси, г; m(смеси) - масса смеси веществ, г.
Тогда
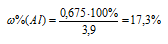
Ответ: 17,3%.
Задача 129.
5,10 г порошка частично окисленного магния обработали соляной кислотой. При этом выделилось 3,74л Н2, измеренного при нормальных условиях. Сколько процентов магния (по массе) содержалось в образце?
Решение:
Уравнение протекающей реакции:
Mg + 2HCl = MgCl2 + H2↑
Мольная масса Mg равна 24,312 г/моль, мольный объём газа равен 22,4 л/моль. Согласно уравнению реакции 1 моль магния выделяет 1 моль водорода. Рассчитаем массу магния, которая растворилась в кислоте из пропорции:
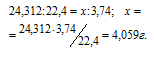
Процентный состав магния в образце определяем из пропорции:
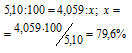
Ответ: 79,6%.

