Задача на определение качественного и количественного состава раствора после реакции
Задача 3.
Медную пластинку известной массы поместили в стакан с 150 г 8% раствора хлорида железа (III). Через некоторое время ее вынули из раствора, промыли, просушили и снова взвесили. Ее масса изменилась на 1,27 г. Определите качественный и количественный (массовую долю всех растворенных в воде веществ) состав раствора после реакции.
Дано:
масса исходного раствора: mисх. р-ра = 150 г;
массовая доля FеС13 в исходном растворе: (FеС13) = 8%;
(FеС13) = 8%;
изменение в массе пластинки: mпласт. = 1,27 г.
mпласт. = 1,27 г.
Найти:
массовую долю всех веществ в растворе после реакции.
Решение:
В условии описана реакция окисления меди ионами железа Fе+3, Причем следует отметить, что железо восстанавливается до степени окисления (+2), так как чистое железо стоит в ряду напряжений левее меди, и она не может восстанавливать ионы Fе+3 до Fе0.
2FеС13 + Сu = 2FеС12 + СuС12.
Из записи реакции видно, что масса медной пластинки уменьшилась на 1,27 г за счет растворения меди. Железно на пластинку не осаждалось. Очевидно, что по окончании реакции в растворе будут находиться, по меньшей мере, две соли: FеС12 и СuС12. Их массу в конечном растворе можно легко определить по массе растворившейся меди, используя уравнение реакции. Кроме того, в растворе после окончания реакции может находиться некоторое количество исходного FеС13. Такое могло произойти в случае, если медную пластинку вынули из раствора еще до полного расходования FеС13. Для проверки возможности нахождения в конечном растворе хлорида желе(III) необходимо по массе растворившейся меди определить массу расходовавшегося FеС13 и сравнить с ее исходным содержанием в растворе FеС13.
По полученным данным легко рассчитать массовую долю каждой соли в конечном растворе.
Алгоритм решения задачи можно представить в виде схемы:
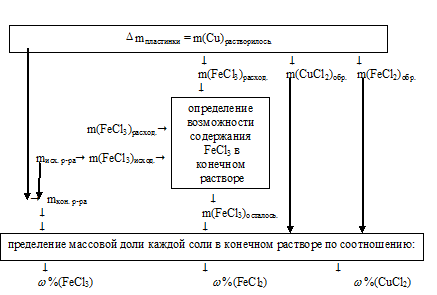
По массе растворившейся меди определяем массу образовавшихся солей: FеС12 и СuС12, а также массу расходовавшегося FеС13:
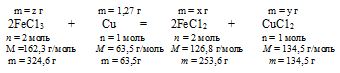
Составляем пропорции:
27 г Сu дают х г FеС12 (по условию)
5 г Сu дают 253,6 г FеС12 (по уравнению)
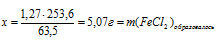
1,2 7 г Сu дают у г СuС12 (по условию)
63,5 г Сu дают 134,5 г СuС12 (по уравнению)

1,27 г Сu взаимодействуют с 2 г FеС13 (по условию)
63,5 г Сu взаимодействуют с 324,6 г FеС13 (по уравнению)
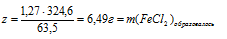
2. Определяем массу FеС13, которая исходно содержалась в растворе:
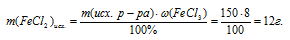
3. Масса FеС13исх. больше, чем масса расходовавшегося хлорида железа (III), следовательно, его часть осталась в конечном растворе.
m(FеС13)осталось = m(FеС13)исх. – m(FеС13)расх. = 12 – 6,49 = 5,51 г.
4. Определим массовую долю каждой соли в конечном растворе.
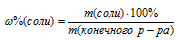
Масса конечного раствора складывается из массы исходного раствора и массы растворившейся с пластинки меди:

Ответ: в конечном растворе содержится три соли:  (FеС12) = 3,35% ;
(FеС12) = 3,35% ;  (СuС12) = 1,78% ;
(СuС12) = 1,78% ;  (FеС13) = 3,64%.
(FеС13) = 3,64%.

