Задача на определение массовой доли всех веществ в растворе после реакции
Задача 4.
Медную пластинку массой 5 г поместили в 200 г 10% - ного раствора нитрата серебра. Через некоторое время пластинку вынули из раствора и снова взвесили. Ее масса изменилась на 1,5 г. Определите массовую долю всех веществ в растворе после реакции.
Дано;
Исходная масса медной пластинки: m(Сu)исх. = 5 г;
масса исходного раствора: mисх. р-ра = 200 г;
массовая доля АgNO3 в исходном растворе:  (АgNO3) = 10%;
(АgNO3) = 10%;
изменение в массе пластинки:  mпластинки = 1,5 г.
mпластинки = 1,5 г.
Найти:
массовую долю всех веществ в растворе после реакции.
Решение:
В условии описана реакция окисления меди ионами серебра Ag+:
Сu + 2АgNО3 = Сu(NO3)2 + 2Аg↓
Причем следует учитывать, что металлическое серебро выделяется на пластинке, а не выпадает на дно реакционного сосуда.
Так как в условии не указано, на каком этапе протекания реакции пластинку вынули из раствора, остается неизвестным, весь ли исходный нитрат серебра принял участие в реакции. Путем изъятия пластинки из раствора мы могли прекратить реакцию в любой момент. В случае, если АgNО3 расходовался не весь, конечный раствор будет содержать смесь солей: Сu(NO3)2 и АgNО3. Таким образом, сначала нам придется определять количество нитрата серебра, принявшего участие в реакции1. Для этого можно использовать разные алгоритмы. Наиболее удобен встречный алгоритм. В нем мы вводим величину «а», которой обозначаем массу (количество, объем) интересующего нас вещества, в данном случае m(АgNО3). Далее, используя введенную величину как известную, по уравнению химической реакции находим массу растворившейся меди и массу выделившегося на пластинке серебра. В итоге, учитывая изменение массы пластинки, составляем математическое уравнение. Его решение дает массу расходовавшегося АgNО3. По ней мы легко рассчитаем массу образовавшегося Сu(NO3)2 и массу оставшегося нитрата серебра (если он остался) в конечном растворе.
Алгоритм решения можно выразить следующей схемой:
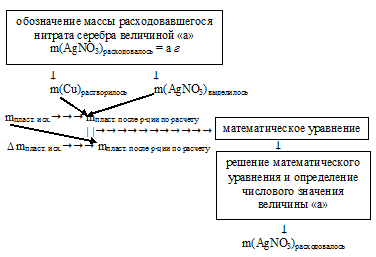
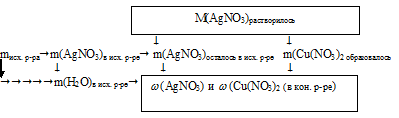
После определения массы расходовавшегося нитрата серебра находим массовые доли солей в конечном растворе по схеме:
1. Обозначим массу расходовавшегося АgNО3 величиной «а»:
m(AgNO3)расход. = а г.
2. Пользуясь величиной «а» как известной определим массу растворившейся с пластинки меди и выделившегося на ней серебра:
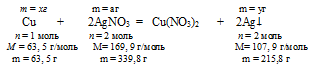
Составим две пропорции:
х г Сu взаимодействуют с а г АgNО3 (по условию)
63,5 г Сu взаимодействуют с 339,8 г АgNО3 (по уравнению)
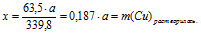
а г АgNО3 дают у г Ag (по условию)
339,8 г АgNО3 дают 215,8 г Ag (по уравнению)
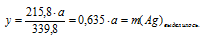
3. Определим массу пластинки после реакции, используя найденные значения масс растворившейся меди и выделившегося серебра:
mпласт. после р-ии =
= mисх. пласт. – m(Cu)растворилось + m(Ag)выделилось =
= 5 – (0,187 . а) + (0,6,35 . а) = 5 + (0,448 . а) г.
4. Определим массу пластинки после реакции по данным из условия.
В условии сказано, что масса пластинки изменилась, но не указано увеличилась она или уменьшилась. По уравнению реакции можно ответить на этот вопрос:
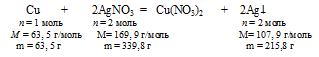
При растворении 63,5 г меди выделяется 215,8 г серебра, следовательно, масса пластики после реакции увеличилась2.
m(пластинки после р-ии) =
= m(исходн. пластинки) +  m = 5 + 1,5 = 6,5 г.
m = 5 + 1,5 = 6,5 г.
5. Используя данные о массе пластинки, полученные двумя разными путями в 3 и 4 действиях, составляем математическое уравнение. Приравниваем значения массы пластинки после реакции:
5 + 0,448 . а = 6,5
Решая уравнение, получим: а = 3,35 г.
Величиной «а» мы обозначали массу расходовавшегося АgNО3: m(AgNO3)расходовалось = 3,35 г.
6. Теперь определим массу оставшегося после реакции нитрата серебра:
m(АgNО3)осталось =
= m(АgNО3)в исх. р-ре – m(АgNО3)расходовалось
Определим m(АgNО3)в исх р-ре по массовой доле и массе раствора (из условия):
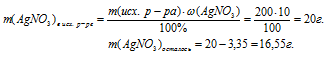
7. Определим массу образовавшегося Сu(NO3)2 по массе расходовавшегося нитрата серебра.
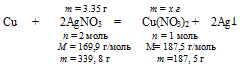
Составим пропорцию:
3,35 г АgNО3 дают х г Сu(NO3)2 (по условию)
339,8 г АgNО3 дают 187,5 г Сu(NO3)2 (по уравнению)
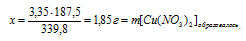
8. Определим массовые доли АgNО3 и Сu(NO3)2 в конечном растворе. Для этого нам потребуется узнать массу воды в растворе. Ее масса не изменилась в процессе реакции, так как вода не принимала в ней участия.
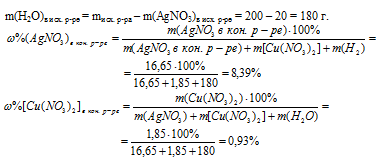
Ответ:  АgNО3 = 8,39%;
АgNО3 = 8,39%;  Сu(NO3)2 = 0,93%.
Сu(NO3)2 = 0,93%.
Комментарии:
1Несмотря на то, что одно из веществ взято в избытке, а другое в недостатке, эта задача не относится к типу «на определение избытка-недостатка». В ее условии указано количество только одного исходного участника реакции (АgNО3). Применение алгоритма определения избытка-недостатка невозможно.
3 В случае других металлов масса пластинки могла и уменьшиться. Это зависит от молярной массы металла и от соотношения коэффициентов перед ними в уравнении реакции. Изменение массы обозначают греческой буквой дельта « ».
».

