Задачи на определение массовой и мольной доли каждой соли в смеси
Задача 33.
Через раствор перманганата калия (КМпО4) пропускали хлороводород до полного обесцвечивания раствора. После реакции раствор выпарили и получили смесь солей. Определите массовую и мольную долю каждой соли в смеси.
Дано:
числовых данных в условии не содержится.
Найти:
массовую и мольную долю каждой соли после реакции.
Решение:
В условии задачи описана реакция окисления хлороводорода раствором перманганата калия. Реакция происходит в кислой среде, т.к. хлороводород очень хорошо растворяется в воде и дает соляную кислоту.
2КМпО4 + 16НСl = 2КСl + 2МпСl2 + 5Сl2↑ + 8Н2О.
Очевидно, что после выпаривания остается смесь солей КСl и МпСl2, причем их соотношение в смеси будет определяться коэффициентами в химической реакции. На каждые 2 моль КСl приходится 2 моль МпСl2. Следовательно, соотношение количеств вещества (п, моль) этих двух солей 2 : 2 или 1 : 1 (после сокращения). Определим мольную долю каждой из солей. Выберем образец смеси, содержащей 2 моль солей. Так как соотношение количеств веществ (п, моль) в смеси 1 : 1, то выбранный образец будет содержать 1 моль КСl и 1 моль МпСl2.
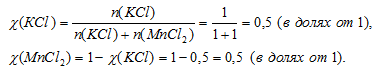
Массовая доля определяется в том же выбранном образце (n(КСl) + n(МnСl2) = 2 моль). Перейдем от количества вещества к массе и вычислим массовую долю:
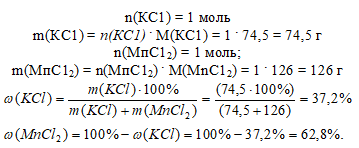
Ответ: 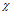 (KCl) =
(KCl) = 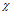 (MnCl2) = 0,5;
(MnCl2) = 0,5;  (KCl) = 37,2%;
(KCl) = 37,2%;  (MnCl2) = 62,8%.
(MnCl2) = 62,8%.
Задача 34.
Кадмиевую пластинку опустили в 70 г 3% -ного раствора FeС13 в воде. После окончания реакции пластинку извлекли из раствора. Определите массовую долю каждой из солей в полученном растворе.
Дано:
масса исходного раствора FеСl3 в воде: mисх. р-ра = 70 г;
массовая доля FеСl3 в исходном растворе:  (FеСl3) = 3%.
(FеСl3) = 3%.
Найти:
массовую долю каждой из солей в конечном растворе.
Решение:
В условии описана реакция окисления металлического кадмия ионами Fе+3. Так как в ряду напряжений металлов кадмий стоит между медью и железом (в случае взаимодействия с металлом, стоящим в ряду напряжения между хромом и медью1), процесс восстановления идет только до Fе+2:2FеСl3 + Сd = 2FеСl2 + СdСl2
В условии указано, что после реакции пластинку вынули из раствора. Это говорит о том, что реакция прошла до конца, и FеСl3 расходовался почти полностью2. Далее задачу можно
решить традиционным образом, используя уравнения реакции.
Можно использовать следующий алгоритм:
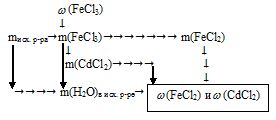
1. Определяем массу FеСl3 в исходном растворе:
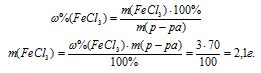
2. Определяем массу воды в исходном растворе:
m(Н2O)в исх. р-ре = mисх. р-ра – m(FеСl3)в исх. р-ре = 70 – 2,1 = 67,9 г.
3. Используя уравнение реакции, определяем массы образовавшихся солей.
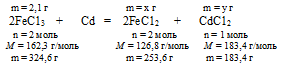
Составим две пропорции:
2,1 г FеСl3 дает х г FеСl2 (по условию) ;
324,6 г FеСl3 дают 253,6 г FеСl2 (по уравнению).
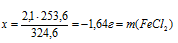
2,1 г FеСl3 дает у г СdСl2 (по условию);
324,6 г FеСl3 дают 183,4 г СdСl2 (по уравнению).
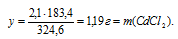
4. Определяем массовую долю FеСl2 и СdСl2 в растворе после реакции:
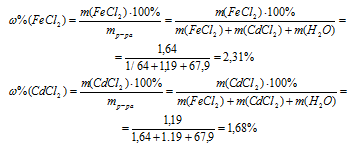
Ответ:  (FеСl2) = 2,31% ;
(FеСl2) = 2,31% ;  (CdCl2) = 1,68%.
(CdCl2) = 1,68%.
Комментарии:
1Обратите внимание, что металлы, стоящие в ряду напряжения левее железа, восстанавливают его из любой степени окисления (при избытке восстанавливающего металла) до чистого железа.
Zn(избыток) + 2FеСl3 = 2Fе + ZnСl2. При недостатке цинка (или любого металла стоящего левее железа) железо из степени окисления (+3) восстановиться до степени окисления (+2).
Zn(недостаток) + 2FеСl3(избыток) = 2FеСl2 + ZnСl2
2 Реально такие реакции представляют собой равновесия, и равновесные концентрации рассчитывают по уравнению Нернста. Этот материал вы будете подробно изучать в вузе. В данном же случае будем считать, что реакция идет до конца.

