Определение массовой доли каждой соли в растворе после реакции
Задача 9.
200 г 7% -ного раствора гидроксида натрия залили 500 г 4,9%-кого раствора Н3РО4. Определите массовую долю каждой соли в растворе после реакции.
Дано:
масса 1-го исходного р-ра гидроксида натрия: m1 исх. р-ра = 200 г;
массовая доля NаОН в 1-м исходном р-ре:  (NаОН)в1 исх. р-ре = 7%;
(NаОН)в1 исх. р-ре = 7%;
масса 2-го исходного раствора Н3РО4: m2 исх. р-ра = 500 г;
массовая доля Н3РО4 во 2-м исходном р-ре:  (Н3РО4)во 2 исх. р-ре = 4,9%;
(Н3РО4)во 2 исх. р-ре = 4,9%;
Найти:
массовую долю каждой соли в конечном растворе.
Решение:
В данной задаче на определение избытка-недостатка между исходными веществами может идти несколько параллельных реакций с образованием разных солей. В данном случае могут получиться:
фосфат натрия Nа3РО4 — средняя соль;
гидрофосфат натрия Nа2НРО4 — кислая соль;
дигидрофосфат натрия NаН2РО4 — кислая соль.
Совместно в конечном растворе может получиться не более двух растворенных веществ, которые не взаимодействуют друг с другом.
Для образования каждой соли запишем химическое уравнение, причем расположим эти уравнения в порядке увеличения кислотности получающейся соли:
3NаОН + Н3РО4 = Nа3РO4 + 3Н2О (реакция №1);
2NaОН + Н3РО4 = Nа2НРО4 + 2Н2О (реакция №2);
NаОН + Н3РО4 = NаН2РO4 + Н2О (реакция №3).
В зависимости от соотношения количеств NаОН и Н3РО4 в конечном растворе могут реализоваться следующие случаи:
а) Nа3РO4 + NаОН(осталось в избытке) при n(NаОН) : n(Н3РО4) > 3 : 1;
б) Nа3РО4 при n(NаОН) : n(Н3РО4) = 3:1;
в) Nа3РО4 + Nа2НРО4 при 3 : 1 > n(NаОН): n(Н3РО4) > 2 : 1;
г) Nа2НРО4 при n(NаОН) : n(Н3РО4) = 2 : 1;
д) Nа2НРО4 + NаН2РО4 при 2 : 1 > n(NаОН): n(Н3РО4) > 1 : 1;
е) NаН2РО4 при n(NаОН) : n(Н3РО4) = 1:1;
ж) NаН2РO4 + Н3РО4 (осталось в избытке) при n(NаОН) : n(Н3РО4) < 1 : 1.
По стандартному алгоритму определим, какое вещество находится в избытке для каждого уравнения.
1. Определим количество вещества NаОН и Н3РО4 в исходных растворах.
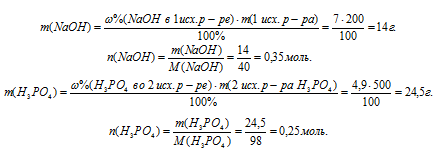
2. Определим избыток-недостаток в первом уравнении. Выберем за основу NаОН и найдем количество вещества Н3РО4, необходимое для образования средней соли
n = 0.35 моль n= х моль
3NаОН + Н3РО4 = Nа3РО4 + ЗН2.
n = 3 моль n = 1 моль
Составим пропорцию:
на 0,35 моль NаОН должно расходоваться х моль Н3РО4 (по усл.);
на 3 моль NаОН расходуется 1 мольН3РО4 (по уравнению).
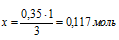 Н3РО4 необходимо, чтобы при реакции со всем NаОН образовалась только средняя соль.
Н3РО4 необходимо, чтобы при реакции со всем NаОН образовалась только средняя соль.
| Количество вещества Н3РО4, которое должно расходоваться для получения средней соли | Количество вещества Н3РО4, которое реально дано в условии и участвует в реакции (из условия задачи) |
| 0,117 моль < 0,25 моль | |
Следовательно, для первой реакции Н3РО4 находится в избытке, а NаОН — в недостатке.
3. Определим избыток-недостаток во втором химическом уравнении. Выберем за основу NаОН и найдем количество вещества Н3РО4, необходимое для образования только гидрофосфата натрия (Nа2НРО4).
n= 0.35 моль n = х моль
2NаОН + Н3РО4 = Nа2НРО4 + 2Н2О.
n = 2 моль n = 1 мель
Составим пропорцию:
на 0,35 моль NаОН должно расходоваться х моль Н3РО4 (по усл.);
на 2 моль NаОН расходуется 1 моль Н3РО4 (по уравнению).
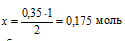 моль Н3РО4 необходимо, чтобы при реакции со всем NаОН образовалась только соль Nа2НРО4.
моль Н3РО4 необходимо, чтобы при реакции со всем NаОН образовалась только соль Nа2НРО4.
| Количество вещества Н3РО4, которое должно расходоваться для получения соли Nа2НРО4 | Количество вещества Н3РО4, которое реально дано в условии и участвует в реакции (из условия задачи) |
| 0,175 моль < 0,25 моль | |
Следовательно, для второй реакции Н3РО4 также находится в избытке, а NаОН в недостатке.
4. Определим избыток-недостаток в третьем уравнении. Выберем за основу NаОН и найдем количество вещества Н3РО4 необходимое для образования дигидрофосфата натрия (NаН2РО4).
n = 0.35 моль n= х моль
NаОН + Н3РО4 = NаН2РО4 + Н2О.
n =1 моль n = 1 моль
Составим пропорцию:
на 0,35 моль NаОН должно расходоваться х моль Н3РО4 (по усл.)
на 1 моль NаОН расходуется 1 моль Н3РО4 (по уравнению)
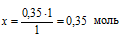 моль Н3РО4 требуется, чтобы при реакции со всем NаОН образовалась только соль NаН2РО4.
моль Н3РО4 требуется, чтобы при реакции со всем NаОН образовалась только соль NаН2РО4.
| Количество вещества Н3РО4, которое должно расходоваться для получения соли NаН2РО4 | Количество вещества Н3РО4, которое реально дано в условии и участвует в реакции (из условия задачи) |
| 0,35 моль > 0,25 моль | |
Следовательно, для третьей реакции Н3РО4 находится в недостатке, а NаОН в избытке.
5. Теперь необходимо определить, какие из возможных реакций идут в действительности при данном соотношении реагентов (NаОН и Н3РО4). Для этого вновь переписываем все возможные реакции в порядке увеличения кислотности получающихся продуктов. Над каждым из исходных веществ укажем избыток или недостаток по результатам предыдущих расчетов:
недостаток избыток
3NаОН + Н3РО4 = Na3РO4 + 3H2O;
недостаток избыток
2NаОН + Н3РО4 = Na2НРO4 + 2H2O;
недостаток избыток
NаОН + Н3РО4 = NaН2РO4 + H2O.
Вещество, находящееся в избытке, поменялось при переходе от второй реакции к третьей. Этот факт и указывает нам, что реально при данном соотношении реагентов идут только вторая и третья реакции. В результате получается две кислые соли: Nа2НРО4 и NаН2РО4. Первая же реакция не реализуется. Соответственно, при решении мы будем использовать только 2 и 3 реакции.
Величинами «a» и «b» в данном случае удобно обозначить количество вещества Nа2НРО4 и МаН2РО4 соответственно.
Алгоритм дальнейших действий можно изобразить следующим образом:
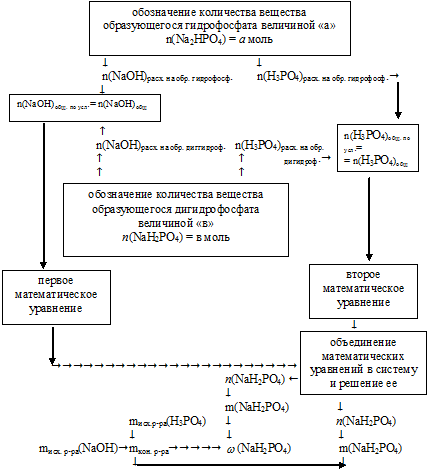
6. Обозначим величиной «а» количество вещества гидрофосфата натрия: n(Nа2НРО4) = а моль.
Величиной «в» обозначим количество вещества дигидрофосфат натрия. n(NаН2РО4) = в моль.
7. Определим количество вещества NаОН и Н3РО4, расходовавшихся на образование а моль Nа2НРО4 (по реакции №2).
n = х моль n = y моль n = а моль
2NаОН + Н3РО4 = Nа2НРО4 + 2Н2О.
n = 2 моль n = 1 моль п = 1 моль
Составим пропорции:
х моль NаОН дают а моль Nа2НРО4 (по условию);
2 моль NаОН дают 1 моль Nа2НРО4 (по уравнению).
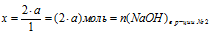
(расходовалось на образование Nа2НРО4).
у моль Н3РО4 дают а моль Nа2НРО4 (по условию);
1 моль Н3РО4 дают 1 моль Nа2НРО4 (по уравнению).
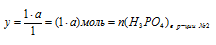
(расходовалось на образование Nа2НРО4).
8. Определим количество вещества NаОН и Н3РО4 , расходовавшихся на образование в моль Nа2НРО4 (по реакции №3).
n = х моль n = y моль n = в моль
NаОН + Н3РО4 = NаН2РО4 + Н2О.
n = 1 моль п = 1 моль п = 1 моль
В данном случае даже без составления пропорции видно, что x = в моль = n(NаОН)в р-ии №3 (расходовалось на образование NаН2РО4), y = в моль = n(Н3РО4)в р-ии №2 (расходовалось на образование NаН2РО4).
9. Запишем выражения для вычисления суммарных количеств веществ NаОН и Н3РО4, расходовавшихся во 2 и 3 реакциях.
n(NаОН)суммарн = n(NаОН)в р-ии №2 + n(NаОН)в р-ии №3=
= (2 . а + b) моль;
n(Н3РО4)суммарн = n(Н3РО4)в р-ии №2 + n(Н3РO4)в р.ии №2 =
= (а + b) моль.
10. Используя данные об общем исходном количестве вещества NаОН и Н3РО4 из условия [n(NаОН)исх = 0,35 моль, n(Н3РO4)исх =0,25 моль] составляем систему математических уравнений:
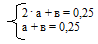
Решая ее, получаем: а = 0,1 моль; b = 0,15 моль.
Величиной «а» мы обозначали количество вещества, образующегося в реакции №2 гидрофосфата натрия:
n(Nа2НРО4) = 0,1 моль.
Величиной «b» мы обозначали количество вещества, образующегося в реакции №3 дигидрофосфата натрия:
n(NаН2РО4) = 0,15 моль.
11. Определяем массы полученных солей и их массовые доли в полученном растворе?
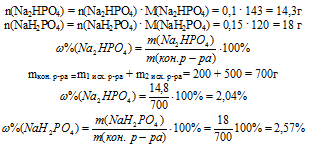
Ответ:  (Nа2НРО4) = 2,04% ;
(Nа2НРО4) = 2,04% ;  (NаН2РО4) = 2,57%.
(NаН2РО4) = 2,57%.
Задачи на определение массовой доли вещества:
1. Определение массовой доли соли
2. Определение массовой доли бензойной кислоты
3. Определение массовой доли глюкозы

