Электронные процессы, происходящие на электродах при электролизе солей
Решение задач на электролиз солей
Задание 277.
При электролизе растворов MgSO4 и ZnСl2, соединенных последовательно с источником тока, на одном из катодов выделилось 0,25 г водорода. Какая масса вещества выделится на другом катоде; на анодах? Ответ: 8,17 г; 2,0 г; 8,86 г.
Решение:
При электролизе солей растворов MgSO4 и ZnСl2, соединенных последовательно с источником тока, на катоде в растворе MgSO4 будет происходить электрохимическое восстановление воды, а на катоде в растворе ZnСl2 – электрохимическое восстановление ионов цинка, поскольку стандартный электродный потенциал системы Mg2+ -2 = Mg0 (-2,36 B) более отрицательней, чем стандартный электродный потенциал водородного электрода в нейтральной среде (-041 В) и стандартный электродный потенциал системы Zn2+ -2
= Mg0 (-2,36 B) более отрицательней, чем стандартный электродный потенциал водородного электрода в нейтральной среде (-041 В) и стандартный электродный потенциал системы Zn2+ -2  = Zn0 (-0,763 B), а также стандартный электродный потенциал водородного электрода в слабокислой среде (0,00 В). Поэтому в электролизёре с MgSO4 на катоде выделяется водород, а в электролизёре с ZnСl2 –металлический цинк.
= Zn0 (-0,763 B), а также стандартный электродный потенциал водородного электрода в слабокислой среде (0,00 В). Поэтому в электролизёре с MgSO4 на катоде выделяется водород, а в электролизёре с ZnСl2 –металлический цинк.
На анодах будут происходить электрохимические окислительные процессы: в растворе MgSO4 будет протекать окисление воды с образованием водорода, а в растворе ZnСl2 – окисление хлрид-ионов с выделением газообразного хлора, так как стандартные электродные потенциалы систем:
2SO42- -2 = S2O82-;
= S2O82-;
2Cl– -2 = Cl20;
2H2O -4 = O2↑ = 4H+
= O2↑ = 4H+
соответственно равны -2,01 В; 1,36 В; 1,23 В.
Количества веществ, выделяющихся при электролизе эквивалентны друг другу:
n(Н2) = n(Cl2) = n(Zn)
Находим количество эквивалентов водорода, выделившегося на катоде:
(Н2) = m(Н2)/МЭ(Н2) =
= 0,25/1 = 0,25 моль.
Тогда
m(O2) = (О2) . МЭ(O2) = 0,25 . 8 = 2 г;
m(Zn) = (Zn) . МЭ(Zn) = 0,25 . 32,66 = 8,17 г’
m(Cl2) = (Cl2) . МЭ(Cl2) = 0,25 . 8,86 = 2 г
Здесь МЭ(Cl2) = 34,45 г/моль; МЭ(O2) = 8 г/моль; МЭ(Zn) = 32,66 г/моль; МЭ(Н2) = 1 г/моль.
Ответ: m(Zn) = 8,17 г; 2,0 г; m(Cl2) = 8,86 г.
Задание 278,
Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора Na2SO4. Вычислите массу вещества, выделяющегося на катоде, если на аноде выделяется 1,12 л газа (н.у.). Какая масса H2SO4 образуется при этом возле анода? Ответ: 0,2 г; 9,8 г.
Решение:
Стандартный электродный потенциал системы Na+ +  = Na0 (-2,71 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода, а ионы Na+, приходящие к катоду, будут накапливаться в прилегающей к нему зоне (катодное пространство):
= Na0 (-2,71 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода, а ионы Na+, приходящие к катоду, будут накапливаться в прилегающей к нему зоне (катодное пространство):
2Н2О + 2 = Н2↑ + 2ОН-
= Н2↑ + 2ОН-
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О - 4 = О2↑ + 4Н+,
= О2↑ + 4Н+,
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему: 2SO42- - 2 = 2S2O82-. Ионы SO42-, движущиеся при этом к аноду, будут накапливаться в анодном пространстве.
= 2S2O82-. Ионы SO42-, движущиеся при этом к аноду, будут накапливаться в анодном пространстве.
Суммарно процесс электролиза Na2SO4 можно представить в молекулярной форме:
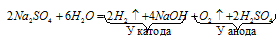
Количества веществ, выделяющихся при электролизе эквивалентны друг другу:
n(Н2) = n(O2) = n(H2SO4)
На аноде выделяется кислород, поэтому количество эквивалентов кислорода равно:
(О2) = V(O2)/VЭ(O2) = 1,12/5,6 = 0,2 моль.
Тогда
m(Н2) = (Н2) . МЭ(Н2) =
= 0,2 . 1 = 0,2 г;
m(Н2SO4) = (Н2SO4) . МЭ(Н2SO4) =
= 0,2 . 49 = 9,8 г;
Здесь МЭ(H2) = 1 г/моль; МЭ(Н2SO4) =
= 49 г/моль; VЭ(O2) = 5,6 л/моль.
Ответ: m(Н2SO4) = 0,2 г; 9,8 г.
Задание 279.
При электролизе раствора соли кадмия израсходовано 3434 Кл электричества. Выделилось 2 г кадмия. Чему равна молярная масса эквивалента кадмия? Ответ: 56,26 г/моль.
Решение:
Расход электричества, необходимый для проведения электролиза равен: Q = I . t = 3434 Кл. Эквивалентную массу металла рассчитаем из уравнения Фарадея относительно массы вещества и количества электричества, подставив в него данные из задачи, получим:
m(В) = МЭ(В) . I . t/F =
= МЭ(В) . Q/F;
МЭ(Ме) = m(В) . F/Q =
= (2 . 96500)/3434 = 56,20 г/моль.
Здесь m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Ответ: МЭ(Ме) = 56,26 г/моль.
Задание 280.
Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН. Чему равна сила тока, если в течение 1 ч 15 мин 20 с на аноде выделилось 6,4 г газа? Сколько литров газа (н.у,) выделилось при этом на катоде? Ответ: 17,08 А; 8,96 л.
Решение:
Стандартный электродный потенциал системы К+ +  = К0 (-2,92 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода, а ионы К+, приходящие к катоду, будут накапливаться в прилегающей к нему зоне (катодное пространство):
= К0 (-2,92 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода, а ионы К+, приходящие к катоду, будут накапливаться в прилегающей к нему зоне (катодное пространство):
2Н2О + 2 = Н2↑ + 2ОН-
= Н2↑ + 2ОН-
На аноде будет происходить электрохимическое окисление ионов ОН-, приводящее к выделению кислорода:
4ОН - 4 = О2↑ + 2Н2О,
= О2↑ + 2Н2О,
поскольку отвечающий этой системе стандартный электродный потенциал (+0,54 В) значительно ниже, чем стандартный электродный потенциал (+1,23 В), характеризующий систему 2Н2О - 4 = О2↑ + 4Н+.
= О2↑ + 4Н+.
Силу тока вычисляем из уравнения Фарадея относительно массы газа, имея в виду, что 1 ч 15 мин 20 с = 4520 с и m(О2) = 6,4 г, получим:
I = m(О2) . F/ МЭО2) . t =
= 6,4 . 96500/8 . 4520 = 17,08 A.
При вычислении объёмов выделившихся газов представим уравнение Фарадея в следующем виде:
V = VЭ . I. t/F
Здесь m(B) – масса выделившегося вещества, г; V – объём выделившегося газа, л; m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Поскольку при нормальных условиях эквивалентный объём водорода равен 11,2 л/моль, получим:
V(Н2) = (11,2 . 17,08 . 5420)/96500 = 8,96 л
Ответ: V(Н2) = 17,08 А; 8,96 л.

