Определите объем газа (н.у.), который получится, если 8 г алюминия поместить в 200 г 8% -ного раствора соляной кислоты.
Определение объема выделившегося газа в реакции, если одно вещество взято в избытке
Определение избытка-недостатка
Задача 6.
Определите объем газа (н.у.), который получится, если 8 г алюминия поместить в 200 г 8% -ного раствора соляной кислоты. Найдите массу раствора после реакции.
Дано:
масса алюминия: m(Аl) = 8 г;
масса соляной кислоты: mр-ра(НСl) = 200 г;
массовая доля хлороводорода в соляной кислоте: (НСl) = 8% .
Найти:
объем выделившегося газа;
массу раствора после реакции.
Решение:
2Аl + 6НСl - 2А1Сl3 + ЗН2↑
Сначала необходимо определить, какое вещество будет в недостатке. По нему можно рассчитать объем выделившегося водорода. Алгоритм вычисления массы конечного раствора зависит от того, какое вещество окажется в избытке, поэтому отразить эту часть решения заранее невозможно. Алгоритм вычисления массы конечного раствора зависит от того, какое вещество окажется в избытке. В большинстве задач на определение избытка-недостатка при растворении металла в растворе в недостатке оказывается именно металл. В этом случае
масса конечного раствора определяется очень просто:
mкон. р-ра = т(Ме) + mисх. р-ра – mгаза.
Если же металл окажется в избытке, то его излишек не будет входить в состав конечного раствора, а опустится на дно сосуда.
Поэтому отразить весь алгоритм решения заранее невозможно.
Схематично алгоритм первой части решения будет иметь вид:
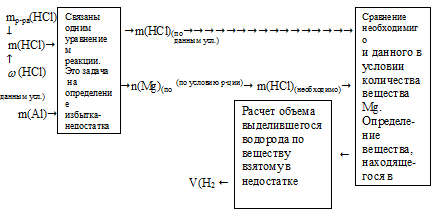
1. Определяем массу НС1 в 200 г 8% -ного исходного раствора.
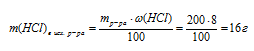
2. Определяем количество веществ НСl и Аl.
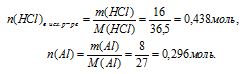
3. Выберем за основу алюминий, и определим по уравнению реакции количество вещества НСl, которое необходимо для полного растворения всего (0,296 моль) алюминия.
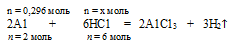
Составляем пропорцию:
на 0,296 моль Аl должно расходоваться х моль НСl (по условию)
на 2 моль А1 полностью расходуется 6 моль НС1 (но уравнению)
х = (0,296 . 6)/2 = 0,888 моль НСl должно расходоваться на 0,296 моль Аl.
4. Определим, какое вещество дано в недостатке.
n(НСl) необходимо - 0,888 моль;
n(НСl) дано по условию - 0,438 моль;
0,888моль > 0,438 моль.
В реакции участвует меньше НСl, чем необходимо для полного растворения А1, следовательно, НСl дано в недостатке. В процессе реакции НС1 израсходуется полностью, а Аl расходуется не весь и часть его останется после реакции.
5. Рассчитаем по уравнению реакции объем (н.у.) выделившегося водорода. Для расчета используем НСl, т.к. это вещество взято в недостатке.
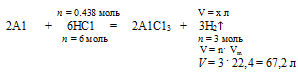
Составляем пропорцию:
0,438 моль НСl дают х л Н2 (по условию);
6 моль НСl дают 67,2 л Н2 (по уравнению);
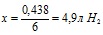
выделится в процессе реакции.
6. Определим массу выделившегося Н2 по алгоритму:
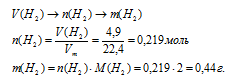
7. Определяем массу раствора после реакции.
mкон. р-ра = m(HCl)р-ра + m(Al)растворившегося – m(H2)выделившегося
При определении массы конечного раствора нужно учитывать, что алюминий находился в избытке, и часть его осталась после реакции в неизменном виде. Не прореагировавший алюминий, очевидно, не входит в состав раствора и будет находиться на дне. Поэтому нам придется определить массу растворившегося Аl. Это можно сделать по уравнению реакции, используя данные по НСl.
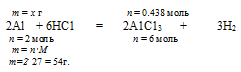
Составляем пропорцию:
х т Аl растворяются в 0,438 моль НСl (по условию);
54 г Аl растворяются в 6 моль НСl (по уравнению);
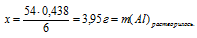
Теперь возможно определить массу конечного раствора:
mкон. р-ра = 200 + 3,95 – 0,44 = 203,51 г.
Ответ: объем выделившегося водорода — 4,9 л; масса конечного раствора 203,51 г.
Определение объема образовавшегося углекислого газа
Задача 7.
Определите объем выделившегося газа при взаимодействии 20,0 г карбоната кальция с избытком азотной кислоты.
Решение:
Несмотря на то, что в условии говориться об избытке азотной кислоты, данная задача не относится к типу «на определение избытка-недостатка». В условии указана масса только одного из участников реакции (СаСО3). Указание на избыток другого участника (НNO3) показывает, что карбонат кальция расходуется полностью и объем выделившегося газа необходимо считать именно по СаСО3.
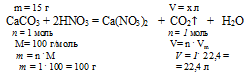
Определим объем образовавшегося углекислого газа из пропорции:
20 г А1 дают х л СО2 (по условию);
100 г А1 дают 22,4 л СО2 (по уравнению);
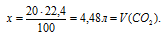
Ответ: V(CO2) = 4,
Задачи на «избыток-недостаток»:
1.
2 . Алгоритм определения избытка-недостатка

