Алгоритм определения избытка-недостатка вещества
Задача 4.
В раствор, содержащий 18 г НСl, добавили 15 г Мg. Определите, какое из веществ в избытке.
Дано:
масса хлороводорода: m(НСl) = 18 г;
масса магния: m(Мg) = 15 г.
Найти:
вещество, находящееся в избытке.
Решение:
1. Все данные об исходных участниках реакции из условия задачи переводим в количество вещества.

2. Записываем уравнение реакции и уравниваем его:
Мg + 2НСl = МgСl2 + Н
n = 1 моль n = 2 моль
По коэффициентам в уравнении реакции определяем соотношение количеств веществ интересующих нас исходных реагентов.
В рассматриваемом случае из уравнения следует, что на полное растворение 1 моль Мg необходимо 2 моль НСl.
3. За основу выбираем одно из исходных веществ участников реакции (любое), по которому известны количественные данные (из первого пункта этого плана). В данном случае это будет либо Мg, либо НСl. Выберем за основу Mg. Далее, используя уравнение реакции и количественные данные по выбранному веществу, рассчитываем количество другого исходного вещества, которое необходимо для полного расходования выбранного вещества.В этой задаче нам придется рассчитать количество НС1, которое необходимо для полного расходования 0,617 моль Мg.
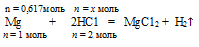
Составляем пропорцию:
на 0,617 моль Мg должно расходоваться х моль НСl (по условию);
на 1 моль Мg полностью расходуется 2 моль НСl (по уравнению р-ии);

HCl необходимо для полного растворения всего указанного в условии магния.
4. Сравнение полученного по пропорции значения количества вещества с данными из условия. Выявление вещества, взятого в избытке, и вещества, взятого в недостатке.
| Количество вещества НС1, которое должно расходоваться для полного растворения всего дан- ного в условии Мg (необходимое количество, определено в третьем действии). | Количество вещества НС1, которое реально дано в условии и участву ет в реакции (из условия задачи, определено в первом действии). |
| 1,234 моль > 0,493 моль | |
Из сравнения видно, что для полного растворения Мg требуется большее количество вещества НСl, чем дано в реальности. Следовательно, НСl находится в недостатке, а Мg — в избытке.
При использовании таких количеств реагентов, которые указаны в условии данной задачи, НСl расходуется полностью, а Мg будет израсходован не весь, и часть его останется после реакции.
Ответ: В избытке взят магний.
Схематично алгоритм определения избытка и недостатка для последней задачи можно выразить следующим образом:
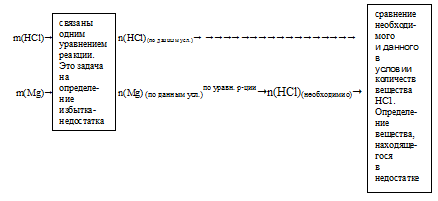
В третьем действии решения мы могли выбрать за основу и НСl. Схема решения была бы немного другой, но ответ получился бы тот же:

Задача 5.
Раствор, содержащий 15 г НNО3, смешали с раствором, содержащим 10 г гидроксида натрия. Определите массу образовавшейся соли.
Дано:
масса азотной кислоты: m(НNО3) = 15 г;
масса гидроксида натрия: m(NаОН) = 10 г.
Найти:
массу образовавшейся соли.
Решение:
НNO3 + NаОН = NаNO3 + Н2О
Запишем схематично алгоритм решения.
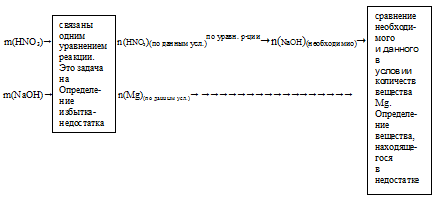
1. Определяем количество веществ НNO3 и NаОН
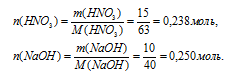
2. Выберем за основу НNO3 и определим по уравнению реакции количество NаОН, которое необходимо для расходования 0,238 моль НNO3.
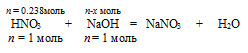
Составляем пропорцию:
на 0,238 моль НNO3 должно расходоваться х моль NаОН (по усл.);
на 1 моль НNO3 полностью расходуется 1 моль МаОН (по уравн. р-ции);
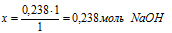
необходимо для полной нейтрализации всей, указанной в условии, азотной кислоты.
3. Определим, какое вещество в недостатке.
| n(NаОН) необходимо | n(NаОН) дано по условию |
| 0,238моль < 0,250 моль | |
Гидроксид натрия находится в избытке и расходуется не весь в процессе реакции. Поэтому дальнейшие расчеты по уравнению реакции будем проводить, используя данные по НNO3.
4. По уравнению реакции определяем массу полученной соли.

Составляем пропорцию:
0,238 моль НNO3 дают х г NaNO3 (по данным условия);
1 моль НNO3 дают 85 г NaNO3 (по уравнению реакции);
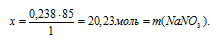
Ответ: m(NаNО3) = 20,23 г.
Задачи на избыток-недостаток:
1. Определение избытка-недостатка

