Эквивалент. Закон зквивалентов. Определение эквивалентной массы вещества
Определение эквивалентной массы вещества
Задача №1
При сгорании 5,00 г металла образуется 9,44 г оксида металла. Определить эквивалентную массу металла.
Решение:
Из условия задачи следует, что в оксиде металла на 5 г металла приходится 4,44 г кислорода (9,44 – 5 = 4,44). Согласно закону эквивалентов, массы (объёмы) взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
5 г металла эквивалентны 4,44 г кислорода
mЭ(Ме) г/моль металла эквивалентны 8 г/моль кислорода
Откуда
mЭ(Ме) = 8 . 5/4,44 = 9,01 г/моль.
Ответ: mЭ(Ме) = 9,01 г/моль.
Задача №2
Одно и то же количество металла соединяется с 0,200 г кислорода и с 3,17 г одного из галогенов. Определить эквивалентную массу галогена.
Решение:
I Вариант
Из условия задачи следует, что 0,200 г кислорода и 3,17 г галогена эквивалентно соединяются с металлом. Согласно закону эквивалентов, массы взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
0,200 г кислорода эквивалентны 3,17 г галогена
mЭ(О2) 8 г/моль кислорода эквивалентны mЭ(Г) Х г/моль
Откуда:
mЭ(Г) 8 . 3,17/0,200 = 126,8 г/моль.
Ответ: mЭ(Г) = 126,8 г/моль.
II Вариант
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
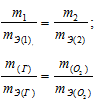
Таким образом, количество эквивалентов галогена и кислорода численно равны между собой, что составляет:
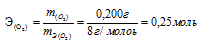
Зная количество эквивалентов и массу вещества можно определить эквивалентную массу этого вещества:
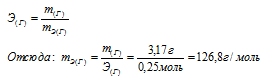
Ответ: 126,8 г/моль.
Задача №3
Масса 1л кислорода равна 1,4 г. Сколько литров кислорода расходуется при сгорании 21 г магния, эквивалент которого равен 1/2 моля?
Решение:
Находим эквивалентную массу магния: mЭ(Mg) = 1/2M(Mg) = 24/2 = 12 г/моль. Следовательно, 21 г магния составляет 21/2 =1,75 эквивалентной массы Mg. Согласно закону эквивалентов масса израсходованного кислорода составляет 1,75 его эквивалентной массы. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, рассчитаем массу кислорода, расходуемую на сжигание магния: m(O2) = 1,75 . 8 = 14 г. Зная, что 1 л кислорода по массе составляет 1,4 г, рассчитаем объём кислорода расходуемого при сгорании 21 г магния, составив пропорцию:
1,4 : 1 = 14 : х;
х = 14 . 1/1,4 = 10 л.
Ответ: V(O2) = 10 л.
Задача№4
Определить эквивалентные массы металла и серы, если 3,24 г металла образует 3,48 г оксида и 3,72 г сульфида.
Решение:
Из условия задачи следует, что в оксиде металла на 3,24 г металла приходится 0,24 г кислорода (3,48 – 3,24 = 0,24 г). Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам). Так как эквивалентная масса кислорода составляет 8 г/моль, то эквивалентную массу металла находим из пропорции:
8 : 0,24 = х : 3,24;
х = 8 . 3,24/0,24 =108 г/моль.
В сульфиде металла на 3,24 г металла приходится 0,48 г серы (3,72 – 3,24 = 0,48 г). Эквивалентную массу серы находим из пропорции:
3,24 : 108 = 0,48 : х;
х = 108 . 3,24/0,48 = 16г/моль.
Ответ: mэ(Me) = 108 г/моль; mэ(S) = 16 г/моль.
Задача№5
Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34 г металла окисляются 0,680 л кислорода (условия нормальные).
Решение:
Зная, что эквивалентный объём кислорода равен 5,6 л/моль, рассчитаем эквивалентную массу металла, составив пропорцию:
8,345 : 0,680 = х : 5,6;
х = 8,34 . 5,6/0,680 = 68,68 г/моль.
Атомную массу металла находим, учитывая, что металл двухвалентный, умножением его эквивалентной массы на 2:
М(Ме) = mэ(Ме) . В, где
В – валентность металла; М – молярная масса металла; mэ(Ме) – эквивалентная масса металла.
М(Ме) = 68,68 . 2 = 137,4 г/моль.
Определяем, какой это металл по таблице «Периодическая система химических элементов Д.И. Менделеева», учитывая, что его атомная масса составляет 137,4. Такой атомной массе соответствует барий – элемент№56.
Ответ: 137,4; Ba.
Задача№6
Мышьяк образует два оксида, из которых один содержит 65,2% (масс.) As, а другой 75,7% (масс.) As. Определить эквивалентные массы мышьяка в обоих оксидах.
Решение:
а) Находим формулу оксида мышьяка, учитывая, что оксид содержит 65,2% As по массе. Тогда оксид содержит кислорода по массе 34,8% (100 – 65,2 = 34,8). Находим формулу оксид мышьяка:
AsхОу = х : у =
= 65,2/Ar(As) : 34,8/Ar(O2) =
= 65,2/74,92 : 34,8/16 =
= 1 : 2,5 = 2 : 5
Формула оксида будет иметь вид: As2O5.
M(As2O5) = 229,84 г/моль.
Находим массу мышьяка и массу кислорода в оксиде:
m(As) = 74,92 . 2 = 149,84 г;
m(O2) = 16 . 5 = 80 г.
Согласно закону эквивалентов массы элементов в оксиде пропорциональны их эквивалентным массам:
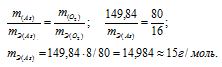
б) Подобные расчеты производим, учитывая, что оксид содержит 75,7% As и 24,3% О2 (100 – 75,7 = 24,3) по массе:
AsхОу = х : у =
= 75,7/74,92 : 24,3/16 =
= 1,01 : 1,51 = 1 : 1,5 2 : 3
Формула оксида будет иметь вид: As2O3.
M(As2O5) = 197,84 /моль.
m(As) = 74,92 . 2 = 149,84 г;
m(O2) = 16 . 3 = 48 г.
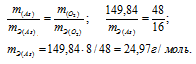
Ответ: а) 15 г/моль; 24,97 г/моль.
Задача№7
1,00г некоторого металла соединяется с 8,89 г брома и с 1,78 г серы. Найти эквивалентные массы брома и металла, зная, что эквивалентная масса серы равна 16,0 г/моль.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их а (объёмам):
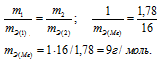
Находим эквивалентную массу брома, учитывая, что эквивалентная масса металла равна 9г/моль:
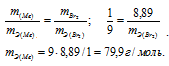
Ответ: 9 г/моль; 79,9 г/моль.
Задача№8
Эквивалентная масса хлора равна 35,5 г/моль, мольная масса атомов меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди?
Решение:
Согласно закону эквивалентов:
mэ(соли) = mэ(Cu) + mэ(Cl2).
Отсюда
mэ(Cl2) = mэ(соли) - mэ(Cl2) =
= 99,5 – 35,5 = 64 г/моль.
Зная эквивалентные массы хлора и меди можно определить количество их атомов в молекуле соли: mэ(А) = М(А)/mэ(А).
Тогда:
CuxCly = x : y =
= 63,5/63,546 : 35,45/35,5 =
= 0,992 : 0,999 = 1 : 1
Отсюда
CuxCly = CuCl.
Ответ: CuCl.
Задача№9.
Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (условия нормальные).
Решение:
M(H2SO4) =98 г/моль.
Находим массу водорода в 14,7 г серной кислоты, составив пропорцию: 98 : 2 14,7 : х;
х = 2 . 14,7/98 = 0,3 г.
Согласно закону эквивалентов массы взаимодействующих веществ пропорциональны их эквивалентным массам:
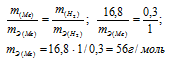
Учитывая, что эквивалентный объём водорода равен 11,2 л/моль, рассчитаем объём который занимает 0,3 г водорода: из пропорции:
1 : 11,2 = 0,3 : х;
х = 11,2 . 0,3/ 1 = 3,36 л.
Ответ: mэ(Ме) = 56 г/моль; V(H2) = 3,36 л.
Задача№10
На восстановление 1,80 г оксида металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Вычислить эквивалентные массы оксида и металла.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
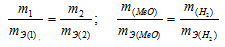
Так как водород находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Мольный объём любого газа при н.у. равен 4 л. Отсюда эквивалентный объём водорода равен, молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000 мл/моль.
Отношение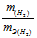 заменим равным ему отношением
заменим равным ему отношением 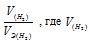 - объём водорода;
- объём водорода; 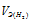 - эквивалентный объём водорода.
- эквивалентный объём водорода.
Тогда получим отношение:
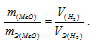
Находим эквивалентную массу оксида металла:
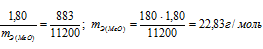
Согласно закону эквивалентов:
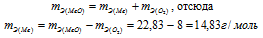
Ответ: 22,83 г/моль; 14,83 г/моль.

