Вычисление количества вещества эквивалента, молярной массы эквивалента, абсолютной атомной и молекулярной массы
Задание 18.
Исходя из молярной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды в граммах.
Решение:
Моль – это количество вещества, в котором содержится число частиц любого определённого сорта равное постоянной Авогадро (6,02 . 1023). Молярная масса вещества – это масса одного моля, выраженная в граммах, (г/моль) и численно равная его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а. е. м. ). Так как атомная масса углерода и молекулярная масса воды соответственно равны 12 и 18 а. е.м., то их молярные массы равны: М(С) = 12 г/моль; М(Н2О) = 18 г/моль. Исходя из того, что 1 моль любого вещества содержит 6,02 . 1023 частиц (атомов или молекул). Рассчитаем массу атома углерода и массу молекулы воды, получим:
- m = M/NA; m = 12/6,02 . 1023 = 2 . 10-23 г;
m = 18/6,02 . 1023 = 3 . 10-23 г.
Ответ: 2,0 . 10-23 г; 3,0 . 10-23 г.
Задание 19.
На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NаОН. Вычислите количество вещества эквивалента, молярную массу эквивалента и основность Н3РО4 в этой реакции. На основании расчета напишите уравнение реакции.
Решение:
М(H3PO4) = 98 г/моль; М(NaOH) =
= 40 г/моль; МЭ(NaOH) = 40 г/моль.
Согласно закону эквивалентов массы (объёмы) реагирующих веществ m1 и m2 пропорциональны их молярным массам (объёмам):
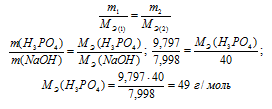
Количество вещества эквивалента равно:
Э = МЭ(H3PO4)/ М(H3PO4) = 49/98 = 0,5 моль.
Основность кислоты определяем делением молекулярной массы на молярную массу эквивалента , получим: М(H3PO4)/ МЭ(H3PO4) = 98/49 = 2. Исходя из того, что основность кислоты равна 2, то количество вещества эквивалента кислоты равно 0,5 моль (1/2 = 0,5).
Уравнение реакции имеет вид:
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
Ответ: 0,5 моль; 49 г/моль; основность кислоты 2.

