Вычисление количества вещества эквивалента, молярной массы эквивалента, молярной и относительной атомной массы
Задача 15.
Избытком хлороводородной (соляной) кислоты подействовали на растворы: а) гидрокарбоната кальция; б) дихлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с HCl и определите количество вещества эквивалентов и молярные массы эквивалента.
Решение:
а) Уравнение реакции:
2HCl + Ca(HCO3)2 = CaCl2 + 2H2O + 2CO2↑
Молярная масса эквивалента кислоты равна её молярной массе делённой на основность (число атомов водорода, содержащихся в молекуле кислоты), значит, МЭ(HCl) = 1/1M(HC). Молярная масса эквивалента сложного вещества, как и молярная масса эквивалента элемента, может иметь различные значения и зависит от того, в какую реакцию обмена вступает это вещество. В данной реакции два эквивалента соляной кислоты реагирует с двумя эквивалентами гидрокарбоната калия. Следовательно, Э(Ca(HCO3)2) равно 2, а эквивалентная масса Ca(HCO3)2 в реакции (а) будет равна МЭ(Ca(HCO3)2)/2 = 162/2 = 81 г/моль.
б) Уравнение реакции:
HCl + AlOHCl2 = AlCl3 + H2O
В данной реакции 1 моль HCl реагируют с 1 моль AlOHCl2, значит, число веществ эквивалентов AlOHCl2 равно 1. Так как AlOHCl2 взаимодействует с одной молекулярной массой эквивалента (молекулой) HCl в реакции (б), то её молярная масса эквивалента равна МЭ(AlOHCl2)/1 = 114,886/1 = 114,886 г/моль.
Задание 16.
При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите молярные массы эквивалента металла и его оксида. Чему равны молярная и относительная атомная массы металла?
Решение:
Учитывая, что МЭ(МеО) = МЭ(Ме) + МЭ(О), находим молярную массу эквивалента оксида металла, получим:
МЭ(МеО) = 27,9 + 8 = 35,9 г/моль.
Молярная масса металла определяется из соотношения МЭ = А/В, где МЭ – молярная масса эквивалента металла; А – молярная масса металла; В – стехиометрическая валентность элемента;
А = МЭ . В = 27,9 . 2 = 55,81 г/моль.
Так как относительная атомная масса в а. е. м. численно равна относительной молярной массе, выраженной в г/моль, то искомая масса металла равна 55,81 а. е. м.
Ответ: 27,9 г/моль; 35,9 г/моль; 55,8 1 /моль; 55,8 а.е.м.
Задание 17.
При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите молярную массу эквивалента, молярную и относительную атомную массы металла.
Решение:
Объём, занимаемый при данных условиях молярной массой эквивалента газообразного вещества, называется молярным объемом эквивалента этого вещества. Молярный объём любого газа при н. у. равен 22,4 л. Отсюда эквивалентный объём водорода VЭ(Н2), молекула которого состоит из двух одновалентных атомов водорода, т.е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л [VЭ(Н2) = VM/2 =22,4/2 = 11,2].
Согласно закону эквивалентов массы (объёмы) реагирующих веществ m1 и m2 пропорциональны их молярным массам (объёмам):
m(Me)/MЭ(Me) = V(H2)/VЭ(H2)
VЭ(H2) - эквивалентный объём водорода; V(H2) - объём водорода.
Тогда
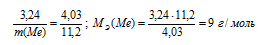
Молярная масса металла определяется из соотношения МЭ = А/В, где МЭ – молярная масса эквивалента металла; А – молярная масса металла; В – стехиометрическая валентность элемента; А = МЭ . В = 9 . 3 = 27 г/моль.
Так как относительная атомная масса в а. е. м. численно равна относительной молярной массе, выраженной
в г/моль, то искомая масса металла равна 27 а. е. м.
Ответ: 9 г/моль; 27 г/моль; 27а. е. м.

