Вычисление количества вещества эквивалента, молярную массу эквивалента и основность фосфористой кислоты
Задание 20.
На нейтрализацию 0,943 г фосфористой кислоты H3PO3 израсходовано 1,291 г КОН. Вычислите количество вещества эквивалента, молярную массу эквивалента и основность кислоты. На основании расчета напишите уравнение реакции.
Решение:
М(H3PO3) = 82 г/моль; М(КOH) = 56,1 г/моль; МЭ(КОН) = 56,1 г/моль.
Согласно закону эквивалентов массы (объёмы) реагирующих веществ m1 и m2 пропорциональны их молярным массам (объёмам):
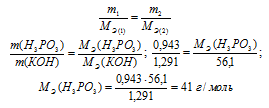
Количество вещества эквивалента равно:
Э = МЭ(H3PO3)/ М(H3PO3) = 41/82 = 0,5 моль.
Основность кислоты определяем делением молекулярной массы на молярную массу эквивалента , получим: М(H3PO4)/ МЭ(H3PO4) = 82/41 = 2. Исходя из того, что основность кислоты равна 2, то количество вещества эквивалента кислоты равно 0,5 моль (1/2 = 0,5).
Уравнение реакции имеет вид:
H3PO3 + 2КOH = К2HPO4 + 2H2O
Ответ: 0,5 моль; 41 г/моль; основность кислоты - 2.

