Способы определения молекулярной формулы оксида и элемента металла, образующего данный оксид
Задача 115.
Некоторый элемент образует оксид вида Э2О3, где Э — неизвестный элемент. Массовая доля кислорода в нем составляет 30,08%. Определите элемент и формулу оксида.
Дано: формула оксида: Э2О3; массовая доля кислорода в оксиде: (О) = 30,08%.
(О) = 30,08%.
Найти: элемент и формулу оксида.
Решение:
Для выявления неизвестного элемента необходимо определить его молярную массу, по которой, пользуясь Периодической системой Д.И.Менделеева, возможно найти неизвестный элемент.
I способ (последовательно-разветвленный алгоритм).
Схематично этот алгоритм можно изобразить так:
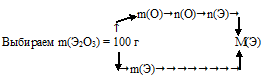
1) Произвольно выбираем некоторую массу образца. Наиболее удобная масса — 100 г, т.к. в условии фигурирует массовая доля. Тогда в 100 г Э2О3 содержится 30,08 г кислорода.
2) По разности находим массу неизвестного элемента:
m(Э) = 100 – m(О) = 100 – 30,08 = 69,92 г содержится в выбранном образце Э2О3.
3) Находим количество вещества атомарного кислорода:
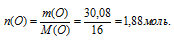
4) По известной общей формуле Э2О3 вычисляем количество вещества атомов неизвестного элемента. На каждые 3 моль атомов кислорода приходится 2 моль атомов неизвестного элемента.
Составим пропорцию:
3 моль атомов кислорода приходится на 2 моль атомов Э
1,88 моль атомов кислорода приходится на х моль атомов Э.
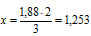 атомов элемента содержится в выбранном образце Э2О3.
атомов элемента содержится в выбранном образце Э2О3.
5) Теперь находим молярную массу атомов неизвестного элемента:
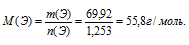
По таблице Д. И. Менделеева находим элемент, имеющий молярную массу 55,8 г/моль. Подходит железо. Этот элемент действительно проявляет степень окисления (+3) и образует оксид Fе2О3.
II способ (встречный алгоритм).
Схематично алгоритм можно изобразить таким образом:
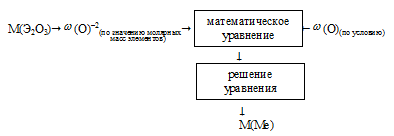
Применим предложенный алгоритм.
1) Записываем выражение для молярной массы Э2О3:
М(Э2О3) = М(Э) . 2 + М(О) . 3 = (М(Э) . 2 + 48) г/моль.
2) Выбираем массу образца Э2О3, соответствующую 1 моль вещества. Она составит m(Э2О3) = (M(Э) . 2 + 48) г. Масса кислорода в этом образце будет 48 г.
3) Записываем выражение для массовой доли кислорода в выбранном образце:
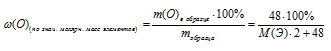
4) Приравниваем полученное выражение к значению массовой доли кислорода из условия:
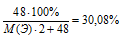
Получили одно уравнение с одним неизвестным М(Э). Решаем его и получаем М(Э) = 55,8 г/моль.
По таблице Д.И. Менделеева находим элемент, имеющий молярную массу 55,8 г/моль. Подходит железо. Этот элемент действительно проявляет степень окисления (+3) и образует оксид Fе2О3.
Ответ: искомый элемент — железо, формула Fе2О3.
Задачи с применением последовательно-разветвленного алгоритма:
1. Определение формулы соли
2. Определение формулы оксида

