Вычисление истинной молярной массы газообразного вещества
Задача 1.28.
В емкости объемом 9 л содержится 23,2 г некоторого углеводорода в газообразном состоянии (н.у.). Определите формулу этого вещества, если известно, что массовая доля углерода в нем составляет 82,76%.
Дано:
объем газообразного углеводорода (н.у.): V = 9 л;
масса 9 литров углеводорода: m = 23,2 г;
массовая доля углерода:  (С) = 82,76%.
(С) = 82,76%.
Найти: молекулярную формулу углеводорода.
Решение:
Шаг 1. В состав углеводорода входит только углерод и водород. Обозначим формулу как СхНу. Следовательно, требуется определить неизвестные индексы х, у.
Шаг 2. В условии нет указаний на химическую реакцию.
Шаг 3. Сначала определим массовую долю водорода. Так как в состав углеводорода входит только углерод и водород, сумма их массовых долей составит 100%:
 (С) + m(Н) - 100%;
(С) + m(Н) - 100%;
 (Н) = 100% –
(Н) = 100% –  (С) =
(С) =
=100% – 82,76% = 17,24%.
Теперь необходимо произвольно выбрать некоторый образец, в котором мы будем определять соотношение количеств веществ элементов. В условии указана информация о массовой доле, поэтому удобно выбрать образец массой 100 г. В этом случае числовые значения массовой доли каждого элемента совпадут с его массой в этом стограммовом образце.
Итак, в 100 г искомого вещества содержится 82,76 г углерода и 17,24 г водорода.
Далее вычислим соотношение количеств вещества (n) углерода и водорода. Используем соотношение m = n . М.
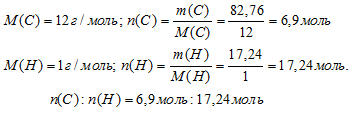
Шаг 4. Находим простейшую формулу.
N(С) : N(Н) = 6,9 : 17,24
Выбираем наименьшее значение (в данном случае «6,9») и делим на него оба числа:
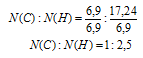
Значения вновь получились не целые. Пробуем их умножать на целые числа от «2» до «5». Видим, что при умножении на «2» получается набор наименьших целых чисел:
N(С) : N(Н) = 2 : 5
Это дает возможность записать простейшую формулу: С2Н5.
Шаг 5. Выявление истинной формулы.
Вещества с формулой С2Н5 не существует. В истинной формуле индексы будут в некоторое число раз больше, чем в простейшей. Для определения, во сколько раз необходимо увеличить индексы в простейшей формуле, сравним истинную молярную массу искомого вещества с молярной массой простейшей формулы. Молярную массу истинной формулы можно определить, используя данные об объеме порции вещества, известной массы. В данном случае алгоритм определения истинной молярной массы вещества будет следующим:
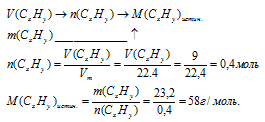
Определим значение молярной массы для простейшей формулы:
Мпрост = 2 .1 2 + 5 . 1 = 29 г/моль.
Истинная молярная масса больше молярной массы простейшей формулы, следовательно, индексы в простейшей формуле необходимо увеличивать.
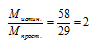
Умножаем индексы в простейшей формуле на «2» и получаем истинную формулу: С4Н10. М(С4Н10) = 58 г/моль. Это формула бутана.
Ответ: С4Н10.

