Определение молекулярной формулы углеводорода по относительной плотности паров по метану
В условиях некоторых задач фигурируют данные, позволяющие определить только молекулярную массу органического вещества. По ним требуется узнать формулу. Чаще всего такие задачи составляются в отношении углеводородов, причем без указания на гомологический ряд, к которому он относится. В этом случае существует иная стратегия решения. Рассмотрим ее на примере.
Задача 54
Определите молекулярную формулу углеводорода, у которого относительная плотность паров по метану составляет 6,875.
Дано: относительная плотность паров углеводорода по метану D(СН4) = 6,875.
Найти: молекулярную формулу углеводорода.
Решение:
В данном случае использовать обычный пошаговый алгоритм не возможно. Но есть иной путь решения, предполагающий составление математического уравнения с несколькими переменными.
Непосредственно из условия задачи установить зависимость между индексами "у" углерода и водорода не представляется возможным. Поэтому, обозначим формулу искомого углеводорода как СхНу. По относительной плотности паров определяем истинную молярную массу СхНу.
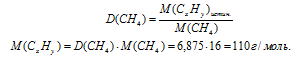
С другой стороны, значение молярной массы нашего вещества можно выразить с помощью молярных масс компонентов:
М(СхНY) = (12 . x) + (1 . y).
Приравниваем полученное выражение к значению истинной молярной массы, определенной по относительной плотности паров:
(12. x) + (1 . y) = 110.
Получили одно уравнение с двумя неизвестными. Других данных, позволяющих составить еще одно уравнение, в условии не содержится.
Полученное нами математическое уравнение имеет бесконечное количество решений. Наша задача — выбрать из них то единственное значение, которое согласуется с физическим смыслом. Посмотрим, какие ограничения на значения «х» и «у» накладывает условие задачи.
1. Значения «х» и «у» в этом уравнении являются индексами в реальной формуле искомого углеводорода, следовательно, они должны быть положительными и целыми числами.
2. В состав молекул углеводорода входит только углерод и водород. Атомы этих элементов значительно различаются по массе. Поэтому вклад атомов углерода в молярную массу всего углеводорода значительно больше, чем вклад атомов водорода1.
Этот факт позволяет по значению молярной массы углеводорода примерно оценить количество атомов углерода в молекуле. Для этого мы пренебрегаем массовым вкладом водорода и упрощаем математическое уравнение. Таким образом, мы избавляемся от члена, отвечающего за вклад водорода в молярную массу (1 . у), и получаем одно уравнение с одним неизвестным2:
12 . х = 110.
Решая его, получаем х = 9,17. Полученное значение не является индексом в формуле углеводорода, но позволяет ограничить количество вариантов при переборе. Оно показывает, что истинный индекс у углерода в искомой формуле близок к 9 и не может быть больше, чем 9. Следовательно, при подборе значений «х» и «у» (в уравнении 12 . х + 1 . у = 110), удовлетворяющих физическому смыслу, разумно начинать перебор значений, начиная с х = 9 с последовательным уменьшением. Приступим к перебору:
|
Задаваемое |
Уравнение | Вычисление значения «y» (индекс у водорода) |
Выводы |
| х = 9 | (12 . 9)+ + (1 . у) |
Y = 2 | Недостаточное количество атомов водорода по сравнению с количеством атомов углерода. Не соответствует ни одному классу углеводородов. Предло- жить структурную формулу вещества |
| ч = 8 | (12 . 8) + + (1 . у) |
Y = 14 | Углеводород с формулой С8Н14 реально существует. Он соответствует общей формуле СnН2n + 2, которая описывает алкины, алкадиены и циклоалкены. |
Дальнейший перебор приводит к избыточному количеству атомов водорода по сравнению с количеством атомов углерода.
Ответ: С8Н14.
----------------------------------------------------------------------------------------------------------------------------
Сокращение количества вариантов перебора путем примерного определения количества атомов углерода в молекуле 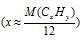 возможно не только для углеводородов. Эта стратегия применима и для других органических веществ, когда возможно упрощение математического уравнения до одного неизвестного. Так, например, задача на определение формулы одноосновной карбоновой кислоты сводится, в конечном итоге, к определению индексов углерода и водорода. Количества атомов кислорода и его вклад в молярную массу известен и определяется одноосновностыо кислоты. Общая формула такой кислоты будет СхНуО2, а математическое уравнение:
возможно не только для углеводородов. Эта стратегия применима и для других органических веществ, когда возможно упрощение математического уравнения до одного неизвестного. Так, например, задача на определение формулы одноосновной карбоновой кислоты сводится, в конечном итоге, к определению индексов углерода и водорода. Количества атомов кислорода и его вклад в молярную массу известен и определяется одноосновностыо кислоты. Общая формула такой кислоты будет СхНуО2, а математическое уравнение:
(12 . х) + (1 . у) + (16 . 2) = М(СхНуО2).
При известной молярной массе кислоты мы получим одно уравнение с двумя неизвестными, одним из которых (1. у) можно пренебречь для примерного определения числа атомов углерода в молекуле:
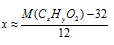
Задачи на определение молекулярной формулы вещества:
1. Определение молекулярной формулы соли
2. Определение молекулярной формулы эфира
3. Определение молекулярной формулы углеводорода
Комментарии:
1 Даже у алканов, у которых вклад атомов водорода в общую молярную массу будет наибольшим среди всех углеводородов, массовая доля водорода не превышает 25% (у метана). У остальных членов этого гомологического ряда вклад водорода еще меньше и с увеличением молярной массы стремиться к 14,29%. У углеводородов других гомологических рядов он еще меньше чем 14,29% .
2 Применительно к любому углеводороду это упрощенное уравнение будет иметь вид: (12 . х) = М(СхНу).

