Определение истинной формулы этана по плотности его паров
Задача 1.27.
В результате анализа некоторого образца газообразного углеводорода в нем обнаружено 5,92 г углерода и 1,48 г водорода. Плотность паров этого вещества при нормальных условиях составляла 1,34 г/л. Найти молекулярную формулу углеводорода.
Дано:
масса углерода: m(С) = 5,92 г;
масса водорода: m(Н) = 18,33 г;
плотность паров искомого вещества: р(СхНу) = 1,34 г/л.
Найти: молекулярную формулу углеводорода.
Решение:
Шаг 1. В состав углеводорода входит только углерод и водород. Обозначим формулу как СхНу. Следовательно, требуется определить неизвестные индексы х, у.
Шаг 2. В условии нет указаний на химическую реакцию.
Шаг 3. Вычислим соотношение количеств вещества (n) углерода и водорода. Используем соотношение: m = n . М.
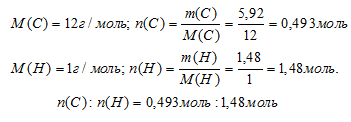
Шаг 4. Находим простейшую формулу.
N(С):N(Н) = 0,493: 1,48
Выбираем наименьшее значение (в данном случае «0,493») и делим на него оба числа:
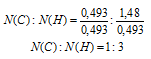
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу: С1Н3.
Шаг 5. Выявление истинной формулы.
Вещество с формулой СН3 не существует. В истинной формуле индексы будут в некоторое число раз больше, чем в простейшей. Для определения, во сколько раз необходимо увеличить индексы в простейшей формуле, сравним истинную молярную массу искомого вещества с молярной массой простейшей формулы. Молярную массу истинной формулы можно определить, используя данные о плотности вещества из условия, по алгоритму:
р(СхНy) → m(порции СхНу объемом 22,4л) →
→ Мистин. (СхНу)
Плотность искомого газообразного вещества составляет 1,34 г/л при н.у. Это значит, что 1 л этого газа имеет массу 1,34 г. Определим массу 22,4 л по пропорции:
1,34 г — масса 1 л газа
х г — масса 22,4 л газа
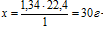 - масса 22,4 л искомого газообразного вещества при нормальных условиях.
- масса 22,4 л искомого газообразного вещества при нормальных условиях.
По закону Авогадро 22,4 л — это объем одного моля любого газа при нормальных условиях. Следовательно, 30 г — это масса 1 моль искомого газа, а это и есть его молярная масса:
Mистин.(СхНу) = 30 г/моль.
Определим значение молярной массы для простейшей формулы:
Мпрост. = 1 . 12 + 3 . 1 = 15 г/моль.
Истинная молярная масса больше молярной массы простейшей формулы, следовательно, индексы в простейшей формуле необходимо увеличивать.
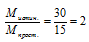
Умножаем индексы в простейшей формуле на 2 и получаем: С2Н6 . М(С2Н6) = 30 г/моль.
Ответ: С2Н6.

