"Химия. 10 класс". О.С. Габриелян (гдз)
Предельные углеводороды (алканы). Крекинг углеводородов
Вопрос 1.
Общая формула алканов имее вид: CnH(2n + 2).
Вопрос 2.
Гексан C6H14 может существовать в форме следующих изомеров:
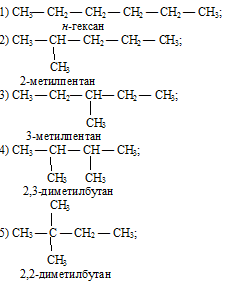
Вопрос 3.
Крекинг — процесс расщепления нефтепродуктов, в результате которого образуются углеводороды с меньшим числом атомов углерода в молекуле. Выделяют термический, каталитический, восстановительный крекинг и крекинг высокого давления.
Вопрос 4.
Возможные продукты крекинга гексана C2H6:
C3H8(пропан), C3H6(пропен), C4H10(бутан), C2H4(этен), C4H8(бутен),
C2H6(этан), CH4(метан), C5H10(пентен).
Вопрос 5.
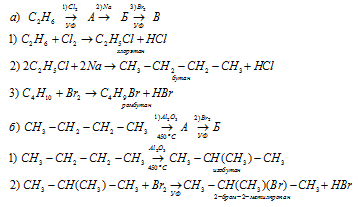
Вопрос 6.
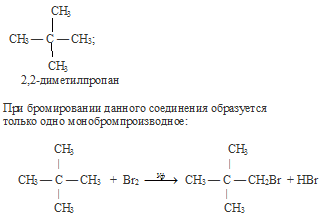
Вопрос 7.
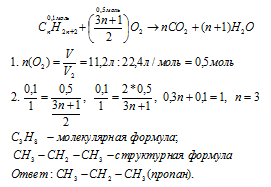
Вопрос 8.
Один моль любого газа при н.у. занимает объем 22,4 л, а масса его равна молекулярной массе, поэтому можем составить пропорцию:
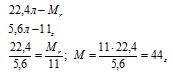
Такую молекулярную массу среди предельных углеводородов имеет пропан:
CH3—CH2—CH3
Ответ: CH3—CH2—CH2(пропан).
Вопрос 9.
Метан применяется в качестве топлива и сырья для химической промышленности. К метану специально добавляют пахучие вещества, чтобы утечка газа могла быть обнаружена, и не произошел взрыв.
Вопрос 10.
При каталитическом окислении метана могут быт, получены вещества метанол или формальдегид и вода:
2CH4 + O2 → 2CH3OH;
CH4 + O2 → HCOH + H2O.
Вопрос 11.
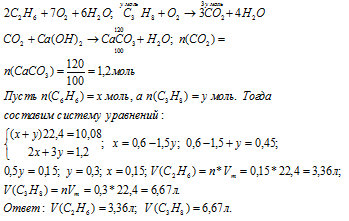
Вопрос 11.
Так как в результате бромирования смеси выделено только 2 пары изомерных монобромалканов и это была смесь (т.е. либо оба продукта газы, либо жидкости, либо твердые тела) и с учетом их средней молекулярной массы Мrcp = D(C2H6) . M(C2H6) = 1,808 . 30 = 54,24 (Минимальная молекулярная масса жидкого алкана (C4H12) равна 72) делаем вывод, что это пропан и бутан. Более тяжелый бутан (может быть н-бутан или н-бутин), но это не имеет значения, оба дают по 2 изомера):
2CH3—CH2— CH3 + Br2 → CH3—CH(Br)—CH3 + CH2—CH2—CH2Br +2HBr;
2CH3—CH2— CH2—CH3 + Br2 → CH3—CH2—CH2(Br)—CH3 + CH3—CH2—CH2—CH2(Br) +2HBr.
Мольную долю пропана обозначим за х, тогда бутана, соответственно за (1-х).
Учтём, что объёмная доля равна мольной доле.
Тогда
44х + 58(1-х) = 54,24;
14х = 3,76;
х = 0,269;
1-х = 0,731.
Ответ: w%об(C6H10) = 73,1%.

