Определение молекулярной и истинной формулы вещества по значению его молекулярной массы
Некоторые задачи в тестах ЕГЭ имеют довольно сложное условие, иногда содержащее избыточные данные. В инструкции для проверяющих содержится тоже сложный вариант решения, предлагающий использование всех данных. Но иногда такие задачи могут быть решены более простым и рациональным способом. Наиболее часто при этом возможно использование стратегии по определению молекулярной формулы по значению молекулярной массы. Приведем наиболее яркий пример такой задачи.
Задача 2.4.
При полном сжигании вещества, не содержащего кислорода, образуются азот и вода. Относительная плотность паров этого вещества по водороду равна 16. Объем необходимого для сжигания кислорода равен объему выделившегося азота. Определите
общую формулу соединения и истинную формулу вещества.
Дано:
относительная плотность паров искомого вещества по водороду: D(Н2) = 16;
равенство объемов расходовавшегося кислорода и выделившегося азота:
V(О2)расх. = V(N2)образов.
Найти: общую и истинную формулу вещества.
Решение:
По содержанию в продуктах реакции водорода и азота можно сделать вывод об их наличии в исходном веществе. Согласно условию, кислород в состав сгоревшего вещества не входил, следовательно, формулу можно записать следующим образом: NxHy. По значению относительной плотности паров находим истинную молярную массу сгоревшего вещества:
M(NxHy) = D(H2) . M(H2) = 16 . 2 = 32 г/моль.
Записываем выражение для молярной массы NxHy, согласно значениям молярных масс элементов:
M(NxHy) = 14 . x + 1 . y.
Приравниваем полученное выражение к значению истинной молярной массы искомого вещества и получаем математическое уравнение с двумя неизвестными:
14 . x + y = 32.
Пренебрегаем вкладом водород в молярную массу вещества и находим приблизительное значение переменной «х»:
14 . x = 32;
x = 2,3.
Переменные «х» и «у» являются индексами в формуле, поэтому они должны быть целыми положительными числами. Согласно примерному определению значения «х», оно не может быть больше «2» (иначе значение «у» станет отрицательным). Предположим, что х = 2, тогда:
14 . x + y = 32;
y = 4.
Следовательно, формула сгоревшего вещества будет N2Н4. Такое вещество реально существует и для него можно предложить структурную формулу, согласующуюся с валентными возможностями азота и водорода:
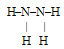
Это — гидразин.
Если же предположить, что х = 1, тогда у = 18. Вещества NН18 не существует, и невозможно предложить его структурную формулу. Таким образом, единственно возможный ответ
в данной задаче N2Н4.
Ответ: N2Н4.
При решении данной задачи мы не использовали информацию о равенстве объемов расходовавшегося кислорода и выделившегося азота. Но предложенный способ приводит к верному ответу и ничем не хуже того, который предложен в инструкции для проверяющих. Для сравнения приведем здесь суть решения, отраженного в вышеуказанной инструкции:
1. Составлено уравнение горения неизвестного соединения с применением буквенных обозначений индексов и коэффициентов:
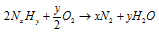
2. Азот и кислород являются газами, и для них применим закон объемных отношений:
V(O2) : V(N2) = n(O2) : n(N2).
Согласно условию, объемы кислорода и азота равны, следовательно: n(O2) = n(N2). Значит и коэффициенты в уравнении перед О2 и N2 тоже равны.
Отсюда получаем соотношение:
x : y = 1 : 2.
Оно показывает соотношение индексов в формуле искомого соединения и позволяет записать простейшую формулу: N1H2.
3. По значению относительной плотности паров искомого вещества по водороду вычисляем истинную молярную массу:
M(NxHy) = D(H2) . M(H2) = 16 . 2 = 32 г/моль.
4. Путем сравнения истинной молярной массы с молярной массой простейшей формулы находим истинную молярную массу сгоревшего вещества:
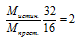
Умножаем все индексы в простейшей формуле на 2 и получаем истинную формулу: N2H4.
Ответ: N2H4.
Задачи на установление молекулярной формулы вещства:
1. Установление молекулярной формулы алкена
2. Установление молекулярной формулы углеводорода
3. Установление молекулярной формулы формальдегида

