Основной способ определения формулы этена
Задача 1.26.
Некоторый образец органического вещества, относящегося к углеводородам, содержит 96 г углерода и 16 г водорода. Определить формулу этого соединения, если его молярная масса равна 28 г/моль.
Дано:
масса углерода: m(С) = 96 г;
масса водорода: m(Н) = 16 г;
М(СхНу) = 28 г/моль.
Найти: молекулярную формулу углеводорода.
Решение:
Шаг 1. В состав углеводорода входит только углерод и водород. Обозначим формулу как СхНу. Следовательно, требуется определить неизвестные индексы х, у.
Шаг 2. В условии нет указаний на химическую реакцию.
Шаг 3. Вычислим соотношение количеств вещества (n) углерода и водорода. Используем соотношение: m = n . М.
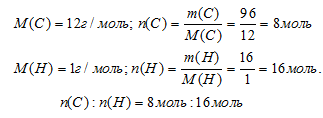
Выбираем наименьшее значение (в данном случае «8») и делим на него оба числа:
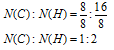
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу: С1Н2.
Шаг 5. Выявление истинной формулы.
Вещества с формулой СН2 не существует. В истинной формуле индексы будут в некоторое число раз больше, чем в простейшей. Для определения, во сколько раз необходимо увеличить индексы в простейшей формуле, воспользуемся значением молярной массы искомого вещества из условия. Это значение является молярной массой истинной формулы Мистин.= 28 г/моль.
Определим значение молярной массы для простейшей формулы:
Мпрост = 1 . 12 + 2 . 1 =14 г/моль.
Отношение истинной молярной массы к молярной массе простейшей формулы показывает во сколько раз индексы в истинной формуле больше чем в простейшей.
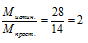
Истинная молярная масса больше молярной массы простейшей формулы в 2 раза, следовательно, все индексы в простейшей формуле необходимо увеличить в два раза. Истинная формула: С2Н4; М(С2Н4) . Мпрост = 14 . 2 = 28 г/моль.
Ответ: С2Н4 — органическое молекулярное вещество этен.

