Определение молекулярной формулы сгоревшего соединения алкена, используя его общую формулу
В условии данной задачи указанна класс, к которому относится искомое вещество. В этом случае решение предполагает знание общей формулы этого класса соединений. Рассмотрим решение подобной задачи.
Задача 75.
Продукты сгорания 118,72 л (н.у.) некоторого газообразного алкена пропустили через избыток известковой воды. В результате выпало 2120 г осадка. Определите молекулярную формулу сгоревшего соединения.
Дано: объем алкена: V(СnН2n) = 118,72 л; масса осадка: mосадка = 2120 г.
Найти: молекулярную формулу алкена.
Решение:
Шаг 1. В состав алкенов входит только углерод и водород.
Общая формула алкенов СnН2n
Шаг 2. В данном случае последовательно идут две химические реакции. Первая из них — горение алкена:
СnН2n + О2 —> СО2 + Н2О (схема реакции).
Далее продукты первой реакции (СО2 и Н2О) пропустили через известковую воду. Известковая вода — это раствор Са(ОН)2 в воде. Из продуктов реакции горения только СО2 реагирует с избытком Са(ОН)2 с выпадением осадка. Образующаяся вода лишь разбавляет раствор. Запишем реакцию взаимодействия СО2 с избытком1 Са(ОН)2:
Са(ОН)2 + СО2 —> СаСО3 + Н2О/
Шаги 3,4. Общая формула алкена CnH2n позволяет сразу определить простейшую формулу и соотношение элементов. Подставим в общую формулу алкенов вместо «n» значение 1 и получим простейшую формулу: С1Н2 Соотношение элементов в ней: п(С) : n(Н) = 1:2.
Шаг 5. Определение истинной молекулярной формулы В задаче нет возможности по молярной массе определить истинную формулу. Но приведенные в условии данные позволяют вычислить количество вещества сгоревшего алкена и количество вещества углерода, который в нем содержался. По этим данным, используя пропорцию, можно определить индекс у углерода в истинной формуле алкена. После этого по общей формуле легко определить индекс у водорода в истинной формуле. В результате получится истинная молекулярная формула. Алгоритм действий схематично будет выглядеть так:
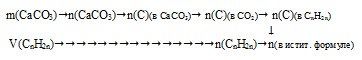
1. Определение количества вещества углерода.
Согласно схеме реакции весь углерод, содержавшийся в СnH2n переходит в СО2. Во второй реакции весь углерод из углекислого газа переходит в СаСО3, который, в свою очередь выпадает в осадок. Следовательно:
n(С)(в СnH2n) = n(C)(в СО2) = n(С)(в СаСО3).
Для определения количества углерода в СnH2n будет достаточно узнать его количество в СаСО3.
Используем алгоритм:
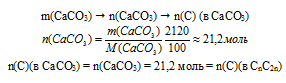
2. Определяем количество вещества сгоревшего алкена.
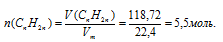
3. Теперь определим индекс у углерода в истинной формуле алкена. Для этого необходимо определить количество вещества атомов углерода в 1 моль алкена. Составим пропорцию:
5,3 моль алкена содержит 21,2 моль атомов углерода
1 моль алкена содержит х моль атомов углерода
x = 21,2 . 1/ 5,3 = 4 моль атомов (С) содержится в 1 моль алкена, следовательно, индекс в формуле алкена у углерода Н = 4. Индекс у водорода определяем по общей формуле СnН2n. Если n = 4, тогда 2 . n = 2 . 4 = 8. Индекс у водорода «8». Истинная молекулярная формула сгоревшего алкена С4Н8.
Ответ: С4Н8.
Задачи на определение молекулярной формулы вещества:
1. Определение молекулярной формулы соли
2. Определение молекулярной формулы эфира
3. Определение молекулярной формулы углеводорода
Комментарии:
1 В случае избытка СО2 и недостатка Са(ОН)2 может получиться кислая растворимая в воде соль гидрокарбоната кальция и не выпадет никакого осадка. Са(ОН)2 + 2СО2 = Са(НСО3)2.

