Определение молекулярной формулы предельного углеводорода
Задача 76.
Некоторый углеводород массой 50 г при взаимодействии с хлором дает 128,4 г дихлорпроизводного. При взаимодействии такого же количества этого углеводорода с бромом образуется 229,5 г дибромпроизводного. Определите молекулярную формулу углеводорода.
Дано: масса углеводорода: (СхНу) — 50 г; масса дихлорпроизводного: mдихлорпроизводпого = 128,4 г; масса дибромпроизводного: mди6ромпроизводного = 229,5 г.
Найти: молекулярную формулу углеводорода.
Решение:
Шаг 1. В состав углеводорода входят углерод и водород. Общая формула неизвестна, поэтому обозначим искомое вещество как СхНу.
Шаг 2. Из условия задачи нельзя сделать вывод о типе реакции. Она может быть как реакцией присоединения, так и реакцией замещения. Запишем эти реакции:
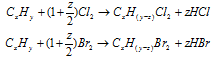
В случае реакции присоединения z = 0, в случае реакции замещения z = 2.
Шаги 3,4. Приведенные в условии данные не позволяют в этих шагах определить соотношение элементов и простейшую формулу.
Шаг 5. По уравнениям реакций хлорирования и бромирования видно, что количество вещества искомого углеводорода равно количеству вещества дигалогенпроизводного. Так как в обеих реакциях участвовало одинаковое количество исходного вещества, можно утверждать, что и количество вещества дихлорпроизводного равно количеству вещества дибромпроизводного. Последний факт позволяет нам, сопоставив значения масс дигалогенпроизводных, определить количество вещества углеводорода, участвовавшего в реакции. Далее, используя значение массы углеводорода, можно определить его молярную массу. В следующем действии по молярной массе определяем индексы в формуле углеводорода. Схематично алгоритм действий можно представить так:
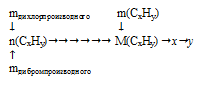
1. Сопоставим массы дихлорпроизводного и дибромпроизводного. Углеводородная часть молекулы каждого из дигалогенпроизводных одинакова, следовательно, разность масс между ними обусловлена различной массой атомов галогенов. Для определения количества вещества дигалогенпроизводного можно составить пропорцию:
при замене атомов (Сl) на (Вг) в 1 моль дигалогенпроизводного;
изменение массы составит (160-71) г (по молярным массам галогенов);
при замене атомов (Сl) на (Вг) в х моль дигалогенпроизводного;
изменение массы составит (229,5 - 128,4) г (по условию)
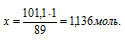
Вне зависимости от типа реакции количество вещества дигалогенпроизводного равно количеству вещества исходного углеводорода:
nгалогенпроизводного = m(СхНу) = 1,136 моль.
2. Определим молярную массу исходного углеводорода:
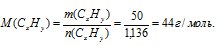
3. Составим математическое уравнение для молярной массы (СхНу):
(12 . х)+ (1 . у) = 44.
Пренебрегая вкладом водорода в молярную массу, примерно оценим количество атомов углерода в молекуле:
12 . х = 44; хприм. = 3,7.
Попробуем подставить в исходное математическое уравнение с двумя неизвестными х = 3 и определить "у":
(12 . 3)+ (1 . у) = 44, у = 8.
Углеводород с формулой С3Н8 действительно существует и участвует в реакциях замещения водорода на галогены.
Ответ: С3Н8.
Задачи на определение молекулярной формулы вещества:
1. Определение молекулярной формулы соли
2. Определение молекулярной формулы эфира
3. Определение молекулярной формулы углеводорода

