Способ определения молекулярной формулы кислоты и элемента металла, образующего кислоту
Задача 116.
70 г некоторой кислоты полностью нейтрализуется 80 г гидроксида калия. Определить формулу кислоты, если в результате реакции нейтрализации получилась соль вида К2ЭО4, где Э — неизвестный элемент.
Дано: масса кислоты: к-ты = 70 г; масса гидроксида калия: m(КОН) = 80 г; общая формула соли: К2ЭО4.
Найти: формулу кислоты.
Решение:
По общей формуле соли К2ЭО4, можно сделать вывод, что мы имеем дело с двухосновной кислотой. Вид кислотного остатка в соли показывает, что на один атом неизвестного элемента в этой кислоте приходится четыре атома кислорода. Таким образом, общая формула неизвестной кислоты: Н2ЭО4.
Расчетную часть решения данной задачи удобно провести по встречному алгоритму. Схематично его можно выразить так:
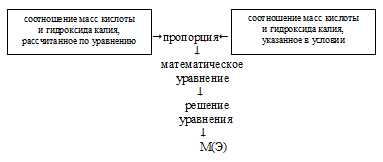
1) Запишем уравнение химической реакции и рассчитаем соотношение масс кислоты и гидроксида калия:
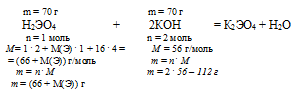
2) Составляем пропорцию:
70 г Н2ЭО4 взаимодействуют с 80 г КОН (по условию)
(66 + М(Э)) г Н2ЭО4 взаимодействуют с 112 г КОН (по уравн.)
3) Из пропорции получаем математическое уравнение с одним неизвестным:
(66 + М(Э)) . 80 = 70 . 112
4) Решая его, получаем значение молярной массы искомого элемента: М(Э) = 32 г/моль.
По таблице Д.И. Менделеева находим элемент, имеющий молярную массу 32 г/моль. Подходит сера. Этот элемент действительно входит в состав серной кислоты, следовательно, искомая кислота — серная Н2SО4.
Ответ: Н2SО4.
Задачи на применение метода встречного алгоритма:
1. Определение массовой доли веществ в растворе;
2. Химические реакции в растворах.
Комментарии:
1 Число атомов водорода, способных замещаться на металл, в кислоте показывает на ее основность. Калий всегда в своих соединениях проявляет степень окисления «+1». Следовательно, 1 атом калия замещает 1 атом водорода. Отсюда можно сделать вывод о том, что молекула кислоты имела 2 атома водорода, т.е. была двухосновной.

