Вычисление массовой доли и титра раствора
Решение задачи по химии на закон эквивалентов
Задание 155.
Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н. раствора NaOН? Каков титр раствора NaOН? Ответ: 0,882 г; 0,0 16 г/см3.
Решение:
Эквивалентная масса HNO3 равна: МЭ(HNO3) = М(HNO3)/1 = 63/1 = 63 г/моль. Эквивалентная масса NaOH равна : МЭ(NaОН) = М(NaОН)/1 = 40/1 = 40 г/моль. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора. Находим число эквивалентов NaOН , содержащихся в 35 см3 его раствора из пропорции:
1000 : 0,4 = 35 : х;
х = (0,4 . 35)/1000 = m0,014Н.
Из закона эквивалентов следует, что вещества реагируют друг с другом в эквивалентных соотношениях. Находим массу HNO3 по формуле:
m(HNO3) = МЭ(HNO3) . СН(HNO3) =
= 63 . 0,014 = 0,882 г
Титром раствора называют число граммов растворенного вещества в 1 см3 (мл) раствора. Находим массу гидроксида натрия, содержащегося в 1 л 0,4Н раствора его:
m(NaOH) = МЭ(NaOH) . СН(NaOH) =
= 40 . 0,4 = 16 г.
Отсюда
Т(NaOH) = 16/1000 = 0,016 г/см3.
Можно титр раствора рассчитать, зная концентрацию эквивалента (СН) и массу эквивалента (МЭ) растворённого вещества по формуле:
Т = СН . МЭ(В)/1000;
Т(NaOH) = 0,4 . 40/1000 = 0,016 г/см3.
Ответ: 0,882 г; 0,0 16 г/см3.
Приготовление раствора
Задание 156.
Какую массу NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Ответ: 100 г.
Решение:
Для расчета используем формулу:
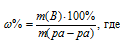
m(B) – масса растворённого вещества; m(ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); - массовая доля растворённого вещества в процентах.
Обозначим массу растворённого вещества через х и подставим данные задачи в уравнение, получим искомую массу NaNO3:
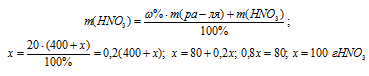
Ответ: 100 г.
Массовая доля раствора
Задание 157.
Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaСI. Чему равна массовая доля полученного раствора? Ответ: 32,5%.
Решение:
Находим массу растворённого вещества в каждом из смешиваемых растворов и суммировав их, получим массу растворённого вещества в смеси:
m(20%) = 300 . 20/100 = 60 г;
m(40%) = 500 . 40/100 = 200 г.
Для вычисления массовой доли смеси слагаем массы вещества, растворённого в обоих растворах, и берём отношение массы растворённого вещества в смеси, выразив его в процентах, получим:
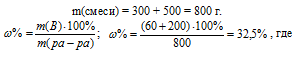
m(B) – масса растворённого вещества m(смеси); m(ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); - массовая доля растворённого вещества в процентах.
Ответ: 32,5%.
Задание 158.
Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова массовая доля полученного раствора? Ответ: 45,72%.
Решение:
Находим массу растворённого вещества в каждом из смешиваемых растворов и суммировав их, получим массу растворённого вещества в смеси:
m(62%) = 247 . 62/100 = 153,14 г;
m(18%) = 145 . 18/100 = 26,1 г;
m(H2SO4) = 153,14 + 26,1 = 179,24 г.
Для вычисления массовой доли смеси слагаем массы вещества, растворённого в обоих растворах, и берём отношение массы растворённого вещества в смеси, выразив его в процентах, получим:
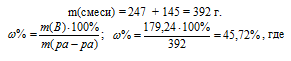
m(B) – масса растворённого вещества m(смеси); m(ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); - массовая доля растворённого вещества в процентах.
Ответ: 45,72%.
Задание 159.
Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна массовая доля оставшегося раствора? Ответ: 84%.
Решение:
Находим массу серной кислоты в растворе:
m(H2SO4) = (700 . 60)/100 = 420 г.
Находим массу раствора после выпаривания:
m(ра-ра) = 700 – 200 = 500 г.
Находим массовую долю оставшегося раствора из формулы:
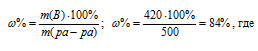
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); - массовая доля растворённого вещества в процентах.
Ответ: 84%.
Задание 160.
Из 10 кг 20%-ного раствора при охлаждении выделилось 400 г соли. Чему равна массовая доля охлажденного раствора? Ответ. 16,7%.
Решение:
Находим массу соли, содержащуюся в растворе:
m(соль) = (10000 . 20)/100 = 2000 г.
Находим массу соли после выпаривания:
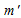 (ра-ра) = 2000 – 400 = 1600 г.
(ра-ра) = 2000 – 400 = 1600 г.
Находим массу раствора после охлаждения:
m(ра-ра) = 10000 – 400 = 9600 г.
Находим массовую долю оставшегося раствора из формулы:
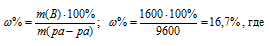
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); - массовая доля растворённого вещества в процентах.
Ответ. 16,7%.

