Молярная концентрация эквивалента, массовая доля и титр раствора
Приготовление раствора
Задание 148.
Какой объем 20,01%-ного раствора HCl (пл. 1,100 г/см3) требуется для приготовления 1 л 10,17%-ного раствора (плотность - 1,050 г/см3? Ответ: 485,38 см3.
Решение:
Масса одного литра 10,17%-ного раствора HCl равна 1000 . 1,050 = 1050 г. В этом растворе содержится (1050 . 0,17)/100 = 106,785 г HCl.
Масса 1 см3 20,01%-ного раствора HCl 1,100 г. Следовательно, в 1 см3 э того раствора содержится
(1,100 . 20,01)/100 = 0,22 г HCl. Для приготовления 1 л 10,17%-ного раствора HCl надо взять 106,785/0,22 = 485,38 см3 20,01%-ногол раствора HCl.
Ответ: 485,38 см3.
Массовая доля раствора
Задание 149.
Смешали 10 см3 10%-ного раствора HNO3 (пл. 1,056 г/см3) и 100 см3 З0%-ного раствора HNO3 (плотность 1,184 г/см3). Вычислите массовую (процентную) долю полученного раствора. Ответ: 28,36%.
Решение:
Масса 10 см3 10%-ного раствора HNO3 равна 10 . 1,056 = 10,56 г. В этом растворе содержится 10,56 . 10/100 = 1,056 г HNO3. Масса 100см3 30%-ного раствора равна 100 . 1,184 = 118,4 г. В этом растворе содержится 118,4 . 30/100 = 35,52 г HNO3.
В общем объеме полученного раствора (110 см3) содержание HNO3 составляет 10,56 + 35,52 = 36,576 г. Масса раствора после смешения равна 10,56 + 118,4 = 128,96 г.
Массовую (процентную) концентрацию определим по уравнению:
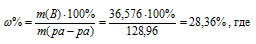
m(B) – масса растворённого вещества; m(ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); - массовая доля растворённого вещества в процентах.
Молярная концентрация раствора СМ = (417,1 . 1000)/(8000 . 63) = 0,83М, где 63 г/моль - молярная масса HNO3.
Ответ: 28,36%;
Приготовление раствора
Задание 150.
Какой объем 50%-ного раствора КОН (пл. 1,538 г/см3) требуется для приготовления 3 л 6%-ного раствора (плотность 1,048 г/см3). Ответ: 245,5 см3.
Решение:
Масса 3 л 6%-ного раствора КОН равна 3000 . 1,048 = 3144 г. В этом растворе содержится
(3144 . 6)/100 = 188,64 г КОН.
Масса 1 см3 50%-ного раствора КОН 1,538 г. Следовательно, в 1 см3 этого раствора содержится (1,538 . 50)/100 = 0,769 г КОН. Для приготовления 3 л 6%-ного раствора КОН надо взять 188,64/0,769 = 245,5 см3 20,01%-ного раствора HCl.
Ответ: 245,5 см3.
Задание 151.
Какой объем 10%-ного раствора карбоната натрия (плотность 1,105 г/см3) требуется для приготовления 5 л 2%-ного раствора (пл. 1,02 г/см3). Ответ: 923,1 см3.
Решение:
Масса 5 л 2%-ного раствора Na2CO3 равна 5000 . 1,02 = 5100 г. В этом растворе содержится (5100 . 2)/100 = 102 г Na2CO3.
Масса 1 см3 10%-ного раствора Na2CO3 1,105 г. Следовательно, в 1 см3 этого раствора содержится (1,105 . 10)/100 = 0,1105 г Na2CO3. Для приготовления 5 л 2%-ного раствора Na2CO3 надо взять 102/0,1105 = 923,1 см3 10%-ного раствора Na2CO3.
Ответ: 923,1 см3.
Молярная концентрация эквивалента и титр раствора
Задание 152.
На нейтрализацию 31 см3 0,16 Н. раствора щелочи требуется 217 см3 раствора Н2SO4? Чему равны молярная концентрация эквивалента и титр раствора Н2SO4?
Ответ: 0,023 Н.; 1,128 . 10-3 г/см3.
Решение:
Согласно закону эквивалентов:
СН (1)V(1) = СН (2)V(2)
Значит, объёмы реагирующих растворов обратно пропорциональны эк этих растворов. Исходя из этого, находим нормальность раствора AgNO3:
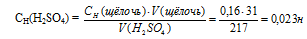
а) Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора.
СН(Н2SO4) =0,023 Н.
б) Титром раствора называют число граммов растворенного вещества в 1 см3 (мл) раствора. Находим массу Н2SO4 в 1 л раствора по формуле:
m(B) = CН(В) . МЭ(В) =
= 0,023 . 49,04 = 1,128 г.
Так как в 1 л раствора содержится 1,128 г кислоты, то
Т(H2SO4) = 1,128/1000 = 1,128 . 10-3 г/см3.
Ответ: 0,023 н.; 1,128 . 10-3 г/см3.
Приготовление раствора
Задание 153.
Какой объем 0,3 Н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOН в 40 см3? Ответ: 26,67 см3.
Решение:
Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора. Находим нормальность раствора NaOH по формуле:
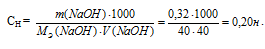
Согласно закону эквивалентов:
СН(NaOH) . V(NaOH) = СН(кислота) . V(кислота)
Значит, объёмы реагирующих растворов обратно пропорциональны нормальности этих растворов. Исходя из этого, находим объём раствора кислоты:
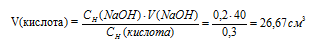
Ответ: 26,67 см3
Молярная концентрация эквивалента раствора
Задание 154.
На нейтрализацию 1 л раствора, содержащего 1,4 г КОН, требуется 50 см3 раствора кислоты. Вычислите молярную концентрацию эквивалента раствора кислоты. Ответ: 0,5 Н.
Решение:
Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора. Находим молярную концентрацию эквивалентность (или нормальность) раствора КОН. Так как эквивалентная масса КОН равна: МЭ(КОН) = М(КОН)/1 = 56,1/1 = 56,1 г/моль, то получим:
СН(КОН) = m(КОН)/ М(КОН) = 1,4/56,1 = 0,025Н.
Согласно закону эквивалентов:
СН (1)V(1) = СН (2)V(2)
Значит, объёмы реагирующих растворов обратно пропорциональны нормальности этих растворов. Исходя из этого, находим нормальность раствора AgNO3:
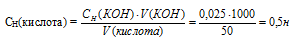
Ответ: 0,5 Н.

