Окислительно-восстановительные свойства сероводорода, серной и азотной кислот
Решение задач на составление электронных и молекулярных уравнений реакций
Задание 372.
Как проявляет себя сероводород в окислительно-восстановительных реакциях? Почему? Составьте электронные и молекулярные уравнения реакций взаимодействия раствора сероводорода: а) с хлором; б) с кислородом.
Решение:
Поскольку в Н2S атом серы находится в своей низшей степени окисления -2, то сероводород всегда будет являться восстановителем во всех окислительно-восстановительных реакциях. На воздухе он горит, окисляясь до SO2, в растворах медленно окисляется кислородом воздуха до свободной серы. С галогенами сероводород окисляется до свободной серы, со многими другими окислителями образуется свободная сера или сульфат-ион.
Уравнения реакций взаимодействия сероводорода с хлором и кислородом:
а) реакция сероводорода с хлором
Уравнения электронного баланса:
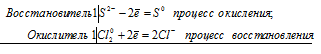
Cl20 + S2- = S6+ + 2Cl-
Молекулярное уравнение реакции:
H2S+ Cl2 = S↓ + 2HCl
б) реакция сероводорода с кислородом
Уравнения электронного баланса:
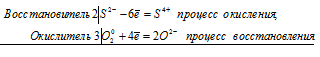
3О20 + 2S2- = 2S4+ + 2О2-
Молекулярное уравнение реакции:
2H2S + 3О2 = 2SО2 + 2H2О
Задание 375
Какие свойства в окислительно-восстановительных реакциях проявляет серная кислота? Напишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием и концентрированной - с медью. Укажите окислитель и восстановитель.
Решение:
Серная кислота обладает окислительными свойствами, если её концентрация превышает 70%. Только при концентрации больше 70% принято говорить о специфических свойствах H2SO4 как окислителя. Серная кислота проявляет окислительные свойства, потому что атом серы в ней находится в своей высшей степени окисления +6 и может только присоединять электроны, т.е. уменьшать свою степень окисления. Разбавленная серная кислота в реакциях с металлами, стоящими в ряду напряжений металлов левее водорода, взаимодействует с ними с выделением водорода. При этом происходит изменение степени окисления атомов водорода, образующих ион Н+, а не атомов серы. С металлами, стоящими в ряду напряжений правее водорода разбавленная серная кислота не взаимодействует.
Уравнения реакций взаимодействия разбавленной серной кислоты с магнием и концентрированной - с медью
а) взаимодействие разбавленной серной кислоты с магнием
Уравнения электронного баланса:
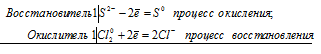
Mg0 + 2H+ = Mg2+ + H20
Молекулярное уравнение реакции:
Mg0 + H2SO4 = MgSO4+ H2↑
Магний увеличивает свою степень окисления от 0 до +2, т. е. является восстановителем, а водород окислитель, потому что уменьшает свою степень окисления от +1 до 0.
б) взаимодействие концентрированной серной кислоты с медью
Уравнения электронного баланса:
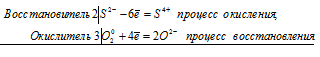
Cu0 + S6+ = Cu2+ + S4+
Молекулярное уравнение реакции:
Cu + 2H2SO4 = CuSO4+ SO2↑ + 2H2O
Задание 384
Чем существенно отличается действие разбавленной азотной кислоты на металлы от действия хлороводородной (соляной) и разбавленной серной кислот? Что является окислителем в первом случае, что - в двух других? Приведите примеры.
Решение:
Действие разбавленной азотной кислоты на металлы заключается в том, что в HNO3 при этом азот уменьшает свою степень окисления от +5 до +2, +1, 0, -3. Объясняется это тем, что при фиксированной концентрации HNO3 могут быть «атакованы» большим числом электронов. Это приводит к снижению степени окисления азота в продуктах восстановления HNO3. Так, для разбавленной HNO3 имеется два случая, характеризующихся выделением NO, при взаимодействии с тяжёлыми металлами, и N2 при взаимодействии окислителя с активными металлами и получаем промежуточный случай для малоактивных металлов продуктом восстановления HNO3 должен являться N2O. Таким образом, при восстановлении HNO3 (разбавленной) активными металлами(от Mg до Cr) продуктом восстановления является N2, а тяжёлыми металлами (от Sb до Au) – NO. Окислителем является атом азота со степенью окисления +5.
Соляная и разбавленная серная кислота при взаимодействии с металлами, стоящими в электротехническом ряду напряжений левее водорода взаимодействуют так, что выделяется Н2. В этом случае окислителем являются ионы водорода Н+, входящие в состав молекул HCl и H2SO4. Хлор и сера вообще не участвуют в окислительном процессе. С металлами, стоящими в ряду напряжений после водорода, соляная кислота и разбавленная серная кислота не взаимодействует, водород не выделяется.
а) Действие разбавленной азотной кислоты на металлы:
3Cu0 + 8HN 5+O3 = 3Cu2+(NO3)2 + 2N2+O↑ + 4H2O;
4Zn0 + 10HN5+O3 = 4Zn2+(NO3)2 + N3-H4NO3 + 3H2O;
5Mg + 12HNO3 = 5Mg(NO3)2 + N2↑ + H2O;
4Fe + 10HNO3 = 4Fe(NO3)2 + N2O + 5H2O
б) Действие разбавленной серной кислоты на металлы:
Zn + H2SO4 = ZnSO4 + H2↑;
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
в) Действие соляной кислоты на металлы:
Zn + 2HCl = ZnCl2 + H2↑;
2Al + 6HCl = 2AlCl3 + 3H2↑
Таким образом, в разбавленной HNO3 (< 65%) роль окислителя играет атом азота в своей степени окисления +5, который уменьшает свою степень окисления от +5 до 0, +1, +2, +4, -3 в зависимости то активности металла. Роль окислителя в соляной кислоте и в разбавленной серной кислоте (< 70%) и который при взаимодействии данных кислот с металла-ми, стоящими в ряду напряжений левее водорода, уменьшает свою степень окисления от +1 до 0.

