Характеристика окислительно-восстановительных свойств серной кислоты
Реакции получения тиосульфата натрия
Задача 866.
Написать уравнение реакции получения тиосульфата натрия. Какова степень окисленности серы в этом соединении? Окислительные или восстановительные свойства проявляет тиосульфат-ион? Привести примеры реакций.
Решение:
Уравнения реакций получения тиосульфата натрия:
а) Водный раствор сульфита натрия кипятят в присутствии серы, а затем охлаждают, выделяется кристаллогидрат тиосульфата натрия:
Na2SO3 + S + 5H2O ↔
↔ Na2S2O3 . 5H2O.
Водный раствор сульфита натрия кипятят в присутствии серы, а затем охлаждают, выделяется кристаллогидрат тиосульфата натрия.
б) Окисление полисульфидов кислородом воздуха:
2Na2S5 + 3O2 ↔
↔ 2Na2S2O3 +6S.
в) Получение тиосульфата натрия путём взаимодействия серы со щёлочью. Реакция протекает с одновременным окислением и восстановлением серы:
4S + 6NaOH ↔
↔ Na2S2O3 + 2Na2S +3H2O.
г) Непосредственное взаимодействие сернистого ангидрида с сероводородом в щелочной среде. Для этого смесь обеих газов пропускают при сильном размешивании в раствор едкого натра до его нейтрализации, то образуется тиосульфат натрия:
4SO2 + 2H2S + 6NaOH ↔
↔ 3Na2S2O3 + 5H2↑.
Атомы серы, входящие в состав тиосульфатов имеют различную степень окисленности; у одного атома степень окисленности равна +4, у другого 0.Тиосульфат-ион S2O32- проявляет свойства восстановителя. Хлор, бром и другие сильные окислители окисляют его до сульфат-иона SO42-, например:
Взаимодействие тиосульфата натрия с хлором (при его избытке):
Na2S2O3 + 4Cl2 + 5H2O ↔
↔ 2H2SO4 + 2NaCl + 6HCl.
Уравнения ионно-молекулярного баланса:
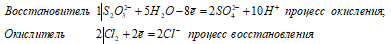
S2O32- + 4Cl20 + 5H2O ↔
↔ 2SO42- + 8Cl- + 10H+.
Молекулярная форма:
Na2S2O3 + 4Cl2 + 5H2O ↔
↔ 2H2SO4 + 2NaCl + 6HCl.
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4, другого – от +4 до +6.
Под действием слабого окислителя тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Взаимодействие тиосульфата натрия с йодом:
2 Na2S2O3 + I2 ↔ Na2S4O6 + 2NaI.
Уравнения ионно-молекулярного баланса:
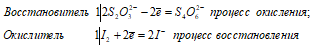
2S2O32- + I20 ↔ S4O62- + 2I-.
Молекулярная форма:
2Na2S2O3 + I2 ↔ Na2S4O6 + 2NaI.
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4. При нагревании свыше 200 0С тиосульфат натрия распадается по схеме:
4Na2S2O  3Na2SO4 + Na2S + 4S↓.
3Na2SO4 + Na2S + 4S↓.
При этом протекает реакция самоокисления-восстановления.
Реакции серной кислоты
Задача 867.
Составить уравнения реакций: а) концентрированной Н2SO4 с магнием и с серебром; б) разбавленной Н2SO4 с железом.
Решение:
а) 4Mg + 5Н2SO4(конц.) →
→ 4MgSO4 + H2S↑) + 4H2O;
б) 2Ag + 2Н2SO (конц.) →
→ Ag2SO4 + SO2↑ + 2H2O;
в) Fe + Н2SO4(разб.) → FeSO4 + H2↑.
Задача 868.
Сколько граммов серной кислоты необходимо для растворения 50 г ртути? Сколько из них пойдет на окисление ртути? Можно ли для растворения ртути взять разбавленную серную кислоту?
Решение:
Уравнение реакции:
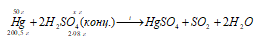
Уравнения ионно-молекулярного баланса:
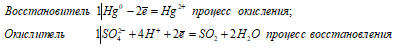
Hg + SO42- + 4H+ ↔
↔ Hg2+ + SO2 + 2H2O.
Из уравнений окисления-восстановления следует, что на окисление 1 моль Hg затрачивается 1 моль H2SO4, следовательно,
200,5 : 98 = 50 : х;
х = (98 . 50)/200,5 = 24,44 г.
Находим массу H2SO4 из пропорции:
200,5 : (2 . 98) = 50 : х;
х = (2 . 98 . 50)/200,5 = 48,88 г.
Ответ: 48,88 г; 24,44 г. Ртуть стоит в ряду напряжений после водорода – поэтому разбавленная серная кислота не действует на ртуть. Следовательно, для растворения ртути нужно взять концентрированную серную кислоту.
Задача 869.
Одинаковое ли количество серной кислоты потребуется для растворения 40 г никеля, если в одном случае взять концентрированную кислоту, а в другом разбавленную? Какая масса серной кислоты пойдет на окисление никеля в каждом случае?
Решение:
Уравнения реакций:
а) Ni + 2H2SO4(конц.) →
→ NiSO4 + SO2↑ + 2H2O;
б) Ni + H2SO4(разб.) → NiSO4 + Н2↑.
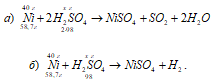
Рассчитаем массу концентрированной серной кислоты идущую на окисление 40 г никеля из пропорции:
58,7 : (2 . 98) = 40 : х;
х = (2 . 98 . 40)/58,7 = 133,56, г.
Теперь рассчитаем массу разбавленной серной кислоты идущую на окисление 40 г никеля из пропорции:
58,7 : 98 = 40 : х;
х = (98 . 40)/58,7 = 66,78 г.
Ответ: 133,56 г; 66,78 г. На окисление никеля расходуется одинаковое количество серной кислоты.

