Характеристика окислительно-восстановительных свойств серы на примере сероводорода и оксида серы Ⅳ
Задача 855.
Какие свойства проявляет сероводород при взаимодействии с водными растворами КМnO4, Н2O2, NaОН?
Решение:
а) При взаимодействии с водным раствором перманганата калия сероводород проявляет свойства восстановителя, окисляясь при этом S-2 до S+6:
3H2S + 8KMnO + 4H2O ↔
↔ 8MnO2↓+ 3H2SO4 + 8KOH.
Уравнения ионно-молекулярного баланса:
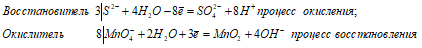
Ионно-молекулярное уравнение:
3S2- + 8MnO4- + 28H2O =
=3SO42- + 8MnO2 + 24H+ + 32OH-.
После приведения членов в обеих частях равенства, получим:
3S2- + 8MnO4- + 4H2O =
= 3SO42- + 8MnO2 +8OH-.
Молекулярная форма:
3H2S + 8KMnO + 4H2O ↔ 8MnO2↓ + 3H2SO4 + 8KOH.
б) При взаимодействии с пероксидом водорода сероводород проявляет свойства восстановителя, окисляясь при этом S-2 до S0:
H2S + Н2О2 = S↓ + 2H2O.
Уравнения ионно-молекулярного баланса:
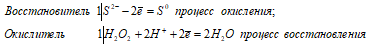
Ионно-молекулярное уравнение:
S2- +H2O2 + 2H+ = S0 + 2H2O.
Молекулярная форма:
H2S + H2O2 = S↓ + 2H2O.
в) С гидроксидом натрия сероводород проявляет свойства кислоты, вступает в реакцию нейтрализации:
H2S +NaOH = NaHS + H2O.
Задача 856.
Закончить уравнения реакций:
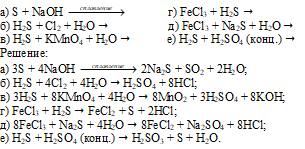
Задача 857.
Привести примеры реакций получения SO2, которые: а) сопровождаются изменением степени окисленности серы; б) не сопровождаются изменением степени окисленности серы.
Решение:
а) Примеры реакций получения SO2, сопровождающиеся изменением степени окисления серы:
1). S + O2 ↔ SO2
Здесь сера выступает в качестве восстановителя, повышая свою степень окисления от 0 до +4;
2). 4FeS2 + 11O2 ↔ 2Fe2O3 + 8SO2↑.
Здесь сера выступает в качестве восстановителя, повышая свою степень окисления от -2 до +4.
б) Пример реакции получения SO2, не сопровождающийся изменением степени окисления серы:
Na2SO3 + H2SO4 ↔ Na2SO4 + SO2↑+ H2O.
Задача 858.
Какова реакция среды в растворах Na2SO3 и NaHSO3? Вычислить рH 0,001 М раствора Na2SO3.
Решение:
1). Na2SO3 - средняя соль, а NaHSO3 – кислая соль сильного основания (гидроксида натрия) и слабой кислоты (угольной кислоты), которые гидролизуются по аниону:
а) Na2SO3 ↔ 2Na+ + SO32-
I ступень:
SO32- + Н2О ↔ HSO3- + OH- (ионно-молекулярная форма);
Na2SO3 + Н2О ↔ NaНSO3 + NaOH (молекулярная форма).
II ступень:
HSO3- + Н2О ↔ Н2SO3 + OH- (ионно-молекулярная форма);
NaНSO3 + Н2О ↔ Н2SO3 + NaOH (молекулярная форма).
Преимущественно соль гидролизуется по первой ступени. При гидролизе образуется избыток ионов ОН-, которые придают раствору основную среду, рН > 7.
б) NaHSO3 ↔ Na+ + НSO3-
НSO3- +Н2О ↔ H2SO3 + OH- (ионно-молекулярная форма);
NaНSO3 + Н2О ↔ Н2SO3 + NaOH (молекулярная форма).
Таким образом, гидролиз Na2SO3 и NaHSO3 протекает по аниону с образованием избытка гидроксид-ионов, что придаёт раствору основную среду.
2). Рассчитаем рН 0,001 М раствора Na2SO3.
Находим степень гидролиза, получим:
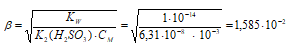
Рассчитаем концентрацию ионов ОН-, получим:
[OH-] = β . CM = (1,585 . 10-2) . 10-3 =
= 1,585 . 10-5 моль/л.
Рассчитаем рОН раствора, получим:
рОН = -lgOH = -lg1,585 . 10-5 =
= 5 - lg1,585 = 5 – 0,20 = 4,8.
Рассчитаем рН раствора, получим:
pH = 14 – pOH = 14 – 4,8 = 9,2.
Ответ: 9,2.

