Получение и свойства сульфидов
Задача 851.
Почему сульфид цинка растворяется в соляной кислоте, а сульфид меди нет? В какой кислоте можно растворить сульфид меди?
Решение:
Взаимодействие сульфида цинка с соляной кислотой выражается уравнением:
ZnS(к) + 2HCl ↔ ZnCl2 + H2S(г).
или
ZnS + 2H+ ↔ Zn2+ + H2S.
Присутствие в числе исходных веществ малорастворимого электролита ZnS, при образовании которого связываются ионы S2-, обуславливает протекание реакции влево. С другой стороны, при образовании слабого электролита H2S также связываются ионы S2-, способствующие протеканию реакции вправо. Таким образом, ионы S2- участвуют в двух процессах, приводящих к установлению двух равновесий:
S2- + Zn2+ ↔ ZnS(к);
S2- + 2Н+ ↔ Н2S(г).
Протекание того или иного процесса зависит от того, какое из двух веществ – сероводород или сульфид цинка – в большей степени связывает ионы S2-. Константа диссоциации H2S (K = K1 . K2 = 6 . 10-22), произведение растворимости ZnS равно 1,3 . 10-23. Из чего вытекает, что связывание ионов S2- в молекулы H2S происходит полнее, чем в ZnS. Поэтому рассматриваемая реакция протекает вправо – сульфид цинка растворяется в соляной кислоте. Аналогично два равновесия устанавливаются в системе CuS—HCl:
S2- +Cu2+ ↔ CuS(к);
S2- + 2Н+ ↔ Н2S(г).
Но произведение растворимости CuS равно 3,2 . 10-38, что меньше, чем 6 . 10-22. Поэтому связывание ионов S2- в CuS происходит полнее, чем в молекулах H2S и, равновесие в системе:
CuS(к) + 2HCl ↔ CuCl2 +H2S(г).
сместится влево; сульфид меди не растворим в растворе соляной кислоты. Следовательно, сульфид меди растворится в растворе той кислоты, суммарная константа диссоциации которой будет иметь меньшее численное значение, чем ПР(CuS), например, ортокремниевая кислота H4SiO4 численное значение К = К1 . К2 . К3 . К4 = 8 . 10-48.
Задача 852.
Каковы продукты реакции взаимодействия хлорида железа (III): а) с сероводородом; б) с сульфидом аммония?
Решение:
а) Хлорид железа (III) и сероводород реагируют с образованием хлорида железа (II), серы и хлороводорода:
2FeCl3 + H2S ↔ 2FeCl2 + S + 2HCl.
Данная реакция протекает по окислительно-восстановительному механизму, где роль окислителя играет FeCl3, а восстановителя – H2S.
б) Между хлоридом железа (III) и сульфидом аммония протекает реакция по обменному механизму с образованием сульфида железа (III) и хлорида аммония:
2FeCL3 + 3(NH4)2S ↔ Fe2S3↓ + 6NH4Cl.
Задача 853.
Объяснить, почему ZnS и РbS можно получить обменной реакцией в водном растворе, а Al2S3 и Cr2S3 нельзя. Указать способ получения Al2S3 и Cr2S3.
Решение:
Малорастворимые сульфиды металлов можно осадить из растворов солей действием сероводорода или сульфида аммония:
Zn(NO3)2 + H2S = MnS↓ + 2HNO3;
Pb(NO3)2 + (NH4)2S = PbS↓ + 2NH4NO3.
Являясь солями слабой кислоты, растворимые сульфиды подвергаются гидролизу. Гидролиз сульфидов, содержащих элементы в высоких степенях окисления Al2S3 и Cr2S3 и др.), часто идет до конца, он необратим. Поэтому Al2S3 и Cr2S3 нельзя получить обменной реакцией в водном растворе. Обычно для их получения используют сплавление метала с серой в отсутствие кислорода и влаги:
2Al + 3S 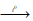 Al2S3;
Al2S3;
2Cr + 3S 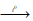 Cr2S3.
Cr2S3.
Сульфид хрома поучают:
Сплавление оксида хрома(III) с сероводородом:
2Cr2O3 + 9S 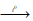 2Cr2S3 + 3SO2↑.
2Cr2S3 + 3SO2↑.
Пропускание сероводорода через нагретый оксид хрома(III):
Cr2O3 + 3H2S 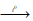 Cr2S3 + 3H2O.
Cr2S3 + 3H2O.
Задача 854.
Какова реакция среды в растворах: а) Na2S; 6) (NH4)2S; в) NaНS?
Решение:
а) Na2S – соль сильного основания и слабой кислоты, гидролизующаяся по аниону:
Na2S ↔ 2Na+ + S2-;
S2- + H2O ↔ HS- + OH- (ионно-молекулярная форма);
Na2S + H2O ↔ NaHS + NaOH (молекулярная форма).
Гидролиз преимущественно протекает по первой ступени, при этом образуется избыток ионов ОН-, которые придают раствору соли щелочную среду, рН > 7.
б) (NH4)2S – соль слабого однокислотного основания и слабой двухосновной кислоты, гидролизуется как по катиону, так и по аниону:
(NH4)2S ↔ 2NH4+ + S2-;
NH4+ + H2O ↔ NH4OH + H+ (ионно-молекулярная форма);
S2- + H2O ↔ HS- + NH4OH (ионно-молекулярная форма).
При гидролизе солей, образованных слабым основанием и слабой кислотой в растворе образуются в избытке как ионы Н+ так и ионы ОН-, которые взаимодействуя друг с другом образуют Н2О:
Н+ + ОН- ↔ Н2О.
Казалось бы, реакция среды должна быть нейтральной по причине образования воды, но, на самом деле, реакция среды бывает или слабокислой, или слабощелочной, что зависит от силы кислоты и основания, образующие соль. Так, если КD основания меньше, чем KD кислоты, то гидролиз соли будет преимущественно протекать по катиону и, следовательно, в растворе будут незначительно преобладать ионы водорода Н+, что придаст раствору слабокислую среду, рН раствора будет незначительно меньше семи. Так как KD(H2S) < KD(NH4OH), то соль будет чуть больше гидролизоваться по аниону, следовательно, в растворе сульфида аммония преобладают ионы ОН-, что придаёт ему слабощелочную среду, рН > 7.
в) NaНS – кислая соль слабой кислоты и сильного основания, которая будет гидролизоваться по аниону:
NaHS ↔ Na+ + HS-;
HS- + H2O ↔ H2S + OH- (ионно-молекулярная форма);
NaHS + H2O ↔ H2S + NaOH (молекулярная форма).
При гидролизе гидросульфида натрия образуется избыток ионов ОН-, которые придают раствору соли щелочную среду, рН > 7.

