Характеристика свойств сульфитов, сульфидов и тиосульфатов
Транспортировка олеума
Задача 870.
Олеум перевозят в железных цистернах. Можно ли заменить их свинцовыми? Почему олеум не растворяет железо?
Решение:
Олеум – это насыщенный раствор SO3 в 96 – 98% H2SO4. Олеум перевозят в железных цистернах, потому что в присутствии серной кислоты, концентрация которой близка к 100%, железо становится пассивным, и взаимодействия его с кислотой практически нет. Олеум нельзя перевозить в свинцовых цистернах, потому что свинец интенсивно растворяется в концентрированной серной кислоте с образованием растворимой кислой соли:
Pb + 3H2SO4(конц.) ↔
↔ Pb(HSO4)2 + SO2↑ + 2H2O.
Разбавленная серная кислота практически не действует на свинец. Это связано с тем, что образуется малорастворимый сульфат свинца, который, откладываясь на поверхности свинца пассивирует его по отношению к кислоте:
Pb + H2SO4(разб.) ↔ PbSO4 + Н2↑.
Железо же в разбавленной серной кислоте растворяется с образованием хорошо растворимого сульфата железа:
Fe + H2SO4(разб.) ↔ FeSO4 + Н2↑.
Таким образом, концентрированную серную кислоту и олеум можно перевозить и хранить в железных ёмкостях, а разбавленную серную кислоту можно хранить в свинцовых емкостях.
Сульфит натрия. Тиосульфат натрия
Задача 871.
По каким свойствам можно отличить сульфит натрия от тиосульфата натрия? Привести уравнения реакций.
Решение:
а) Сульфит натрия является средней солью сернистой кислоты. Атомы серы в сульфите натрия находятся в своей промежуточной степени окисления +4, поэтому он в реакциях окисления-восстановления может быть как восстановителем, так и окислителем. Например, свободные галогены могут восстанавливаться им до галогеноводородов:
Na2SO3 + Cl2 + H2O ↔
↔ Na2SO4 + 2HCl.
Как окислитель сульфит натрия может реагировать с сильными восстановителями, например, с сероводородом:
Na2SO3 + 3H2S ↔
↔ 3S↓ + Na2S + 3H2O.
Сульфит натрия при прокаливании может разлагаться до сульфата натрия и сульфида натрия:
4Na2SO3  3Na2SO4 + Na2S.
3Na2SO4 + Na2S.
При этом протекает реакция самоокисления-восстановления.
б) Тиосульфат натрия Na2S2O3 содержит один атом серы в степени окисления 0, а другой – в степени окисления +4. Поэтому тиосульфат натрия в реакциях окисления-восстановления может быть как восстановителем, так и окислителем. Например, свободные галогены хлор или бром, как сильные окислители, окисляют его до серной кислоты или до её соли:
Na2S2O3 + 4Cl2 + 5H2O ↔
↔ 2H2SO4 + 2NaCl + 6HCl.
Окисление тиосульфата натрия слабыми окислителями протекает иначе, например, под действием свободного йода тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6:
2Na2SO3 + I2 ↔
↔ Na2S4O6 + 2NaI.
Эта реакция служит основой йодометрического метода определения некоторых окислителей и восстановителей.
Как окислитель тиосульфат натрия может реагировать с сильными восстановителями, например, с сероводородом:
Na2S2O3 + 3H2S ↔
↔ 4S↓+ Na2S + 3H2O.
При нагревании свыше 200 0С тиосульфат натрия распадается по схеме:
4Na2S2O3  3Na2SO4 + Na2S + 4S↓
3Na2SO4 + Na2S + 4S↓
При этом протекает реакция самоокисления-восстановления при которой в осадок выпадает свободная сера.
Задача 872.
Указать вещества, содержание значительных количеств которых в воздухе несовместимо с присутствием озона: а) SO2; б) НF; в) Н2S; г) СО2 д) N2.
Решение:
Озон не реагирует ни с НF, ни с СО2, ни с N2.
Озон может окислят сероводород в атмосфере:
H2S + O3 = H2O + SO2
В свою очередь сернистый газ может далее окисляться озоном:
SO2 + O3 = SO3 + O2
Образовавшийся оксид серы (VI) реагирует с атмосферной влагой:
SO3 + H2O = H2SO4.
Уравнение в общем виде:
3SO2 + 3Н2О + O3 ↔ 3H2SO4.
Значит, вещества, содержание значительных количеств которых в воздухе несовместимо с присутствием озона это SO2 и Н2S.
Задача 873.
Каково соотношение рН изомолярных растворов сульфида (рН1), селенида (рН2) и теллурида (рН3) натрия: а) рН1 < рН2 < рН3; б) рН1 = рН2 = рН3; в) рН1 > рН2 > рН3?
Решение:
а) NaS, б) NaSe, в) NaTe - соли сильного основания и слабых двухосновных кислот гидролизуется по аниону (с учётом того, что гидролиз протекает по первой ступени):
S2- + H2O ↔ HS- + OH-;
Se2- + H2O ↔ HS- + OH-;
Te2- + H2O ↔ HS- + OH-.
Константы диссоциации кислот H2S, H2Se, H2Te соответственно равны: 6 . 10-8; 1,7 . 10-4; 1 . 10-3. Определяем рН растворов солей:
а) для NaS, получим:
Определяем степени гидролиза сульфида:
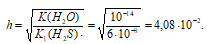
Здесь h - , показывает долю гидролизованных ионов. В изомолярных растворах h =CМ. Значит концентрация образовавшихся ионов ОН-:
[OH-] = 4,08 . 10-2 моль/л;
рОН = -lg[OH-] = -lg4,08 . 10-2 =
= 2 - lg4,08 = 2 – 0,61 = 1,4;
pH = 14 – pOH = 14 – 1,4 = 12,6.
б) для NaSе, получим:
Определяем степень гидролиза соли:
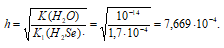
Значит концентрация образовавшихся ионов ОН- :
[OH-] = 7,67 . 10-4 моль/л;
рОН = -lg[OH-] = -lg7,67 . 10-4 =
= 4 - lg7,67 = 4 – 0,88 = 3,12;
pH = 14 – pOH = 14 – 3,12 = 10,9.
в) для NaТе, получим:
Определяем степень гидролиза соли:
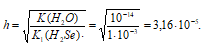
Значит концентрация образовавшихся ионов ОН-:
[OH-] = 3,16 . 10-5 моль/л;
рОН = -lg[OH-] = -lg3,16 . 10-5 =
= 4 – lg3,16 = 5 – 0,50 = 4,5;
pH = 14 – pOH = 14 – 4,5 = 9,5.
Так как 12,6 > 10,9 > 9,5, то рН1 > рН2 > рН3.
Ответ: в).

