Как решать задачи с участием кислот и оснований
Задача 140.
Написать формулы ангидридов указанных кислот: H2SO4; H3BO3; Н4P2O7; НОСI; HMnO4.
Решение:
Ангидридами кислот называют оксиды, которые при взаимодействии с водой образуют кислоту.
Тогда
H2SO4 – серная кислота, которой соответствует ангидрид SO3;
H3BO3 – ортоборная кислота, которой соответствует ангидрид B2O3;
H4P2O7 – тетраметафосфорная кислота, которой соответствует ангидрид P2O5;
HOCl – хлорноватистая кислота, которой отвечает ангидрид Cl2O;
HMnO4 – марганцевая кислота, которой отвечает ангидрид Mn2O7.
Задача 141.
Написать формулы оксидов, соответствующих указанным гидроксидам: H2SiО3; Сu(ОН)2; Н3АsО4; Н2WO4; Fе(ОН)3.
Решение:
H2SiО3 – кремниевая кислота, которой соответствует оксид SiO2;
Сu(ОН)2 – гидроксид меди (II), которому соответствует оксид CuO;
Н3АsО4 - мышьяковая кислота, которой соответствует оксид As2O5;
Н2WO4 – вольфрамовая кислота, которой соответствует оксид WO3;
Fе(ОН)3 – гидроксид железа (III), которому соответствует оксид Fe2O3.
Задача 142.
Составить уравнения реакций, с помощью которых можно осуществить указанные превращения:
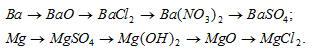
Решение:
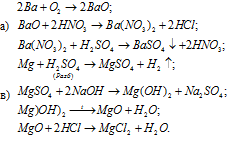
Задача 143.
Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
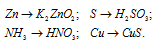
Решение:
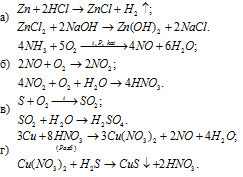
Задача 144.
Какие из указанных газов вступают в химическое взаимодействие с раствором щелочи: НСI, Н2S, NO2, N2, С12, СН4, SO2, NH3? Написать уравнения соответствующих реакций.
Решение:
С раствором щёлочи в обычных условиях реагируют следующие газы: НСI, Н2S, NO2, С12, SO2. Азот (N2), метан (СН4) и аммиак (NH3) в обычных условиях не взаимодействуют с раствором buzani.ru/raznoe/stati/1594-klassifikatsiya-neorganicheskikh-veshchestv.
Уравнения реакций:
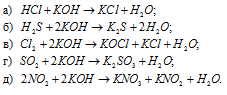
Задача 145.
Какие соли можно получить, имея в своем распоряжении CuSO4, AgNO3, К3PO4, ВаСI2? Написать уравнения реакций и назвать полученные соли.
Решение:
Имея в своём распоряжении CuSO4, AgNO3, К3PO4, ВаСI2 можно получить следующие соли:
а) При взаимодействии CuSO и К3PO4 образуется нерастворимая соль ортофосфат меди:
3CuSO4 + 2К3PO4 = Cu3(PO4)2↓ + 3K2SO4
б) Реакция CuSO4 с ВаСI2 протекает с выпадением в осадок нерастворимого сульфата меди:
CuSO4 + ВаСI2 = BaSO4↓ + CuCl2
в) при взаимодействии AgNO3 и К3PO4 образуется нерастворимая соль фосфата серебра:
3AgNO3 и К3PO4 = Ag3PO4↓ + 3KNO3
г) При сливании растворов AgNO3 и ВаСI2 выпадает осадок нерастворимого хлорида серебра:
2AgNO3 + ВаСI2 = 2AgCl↓ + Ba(NO3)2
д) При сливании растворов К3PO4 и ВаСI2 выпадает осадок нерастворимого ортофосфата бария:
2К3PO4 + 3ВаСI2 = Ba3(PO4)3↓ + 6KCl.
Таким образом, можно получить следующие нерастворимые соли: Cu3(PO4)2 – ортофосфат меди (II); BaSO4 – сульфат бария; Ag3PO4 – ортофосфат серебра; AgCl – хлорид серебра; Ba3(PO4)2 – ортофосфат бария.
Задача 146.
Назвать следующие соединения: К2О2, МnO2, ВаО2, МnО, СrO3, V2O5.
Решение:
а) К2О2 – пероксид калия;
б) МnO2 - оксид марганца (IV);
в) ВаО2 – пероксид бария;
г) МnО – оксид марганца (II);
д) СrO3 – оксид хрома (VI);
е) V2O5 – оксид ванадия (V).
Задача 147.
Как доказать амфотерный характер ZnO, А12O3, Sn(ОН)2, Cr(ОН)3?
Решение:
а) ZnO – оксид цинка – амфотерный оксид, который реагирует с кислотами, образуя соль и воду, с основаниями – цинкаты.
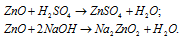
б) А12O3 – оксид алюминия – амфотерный оксид, который реагирует с кислотами с образованием соли и воды, с основаниями – алюминаты.
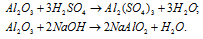
в) Sn(ОН)2 – гидроксид олова (II) – амфотерный гидроксид, который реагирует с кислотами, образуя соль и воду, с основаниями – тригидроксостаннаты (II).
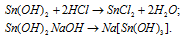
г) Cr(ОН)3 – гидроксид хрома (III) амфотерный гидроксид, который реагирует с кислотами, образуя соль и воду, с концентрированным раствором NaOH – гексагидроксохроматы (III).
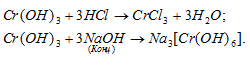
Задача 148.
Можно ли осуществить в растворах указанные ниже реакции:
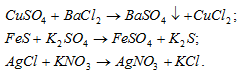
Решение:
а) Хлорид бария и другие его растворимые соли являются качественными реактивами на обнаружение ионов SO42– В результате реакции выпадает осадок нерастворимого сульфата бария:
CuSO4 + ВаСI2 = BaSO4↓ + CuCl2
б) Сульфид железа нерастворимая соль, поэтому при приливании к нему раствора сульфата калия реакция не идёт. Потому что в растворе находятся только ионы K+ и SO42-, которые образуются при диссоциации сульфата калия, как сильного электролита:
K2SO4 ⇔ 2K+ + SO42-
Ионы K+ и SO42- не связываются с ионами воды H+, OH- и молекулами FeS – реакция не идёт.
в) AgCl – нерастворимая соль, поэтому при приливании к ней раствора KNO3 реакция не идёт. Потому что в растворе находятся только ионы K+ и NO3- , которые образуются при диссоциации сильного электролита нитрата калия:
KNO3 ⇔ K+ + NO3-
Ионы K+ и NO3- не связываются с ионами воды H+, OH- и молекулами AgCl – реакция не идёт.

