Окислительно-восстановительные свойства олова и свинца
Задание 365
Какая степень окисления наиболее характерна для олова и, какая для свинца? Составьте электронные и молекулярные уравнения реакций олова и свинца с концентрированной азотной кислотой.
Решение:
Для олова в одинаковой степени характерны степени окисления +2 и +4. Для олова в одинаковой степени характерны степени окисления +2 и +4.
Для свинца наиболее характерна степень окисления +2 и в меньшей степени +4.
Уравнения реакций олова и свинца с концентрированной азотной кислотой:
а) При взаимодействии олова с концентрированной азотной кислотой образуются - оловянная кислота H2SnO3 и оксид азота (IV) NO2:
Sn + 4HNO3 =
= H2SnO3 + 4NO2↑ + H2O
Уравнения электронного баланса:
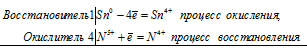
Sn0 + 4N5+ = Sn4+ + 4N4+
Sn + 4HNO3 =
= H2SnO3 + 4NO2↑ + H2O
б) При взаимодействии свинца с концентрированной азотной кислотой образуются нитрат свинца Pb(NO3)2 и оксид азота (IV) NO2:
Pb + 2HNO3 =
= Pb(NO2)2 + NO2↑ + 2H2O
Уравнения электронного баланса:
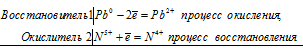
Pb0 + 2N5+ = Pb2+ + 2N4+
Pb + 2HNO3 =
= Pb(NO2)2 + NO2↑ + 2H2O
Задание 366.
Чем можно объяснить восстановительные свойства олова (II) и окислительные свинца (IV)? На основании электронных уравнений составьте уравнения реакций: а) SnCl2 с НgCl2; б) РЬО2 с НСl (конц.).
Решение:
Олово и свинец на внешнем энергетическом уровне содержат по четыре электрона. Так как олово (II) на внешнем энергетическом уровне содержит два электрона, то оно может их отдать, т. е. проявить свойства восстановителя. Свинец (IV) на внешнем энергетическом уровне не содержит электронов, поэтому свинец (IV) может присоединить недостающие электроны, проявив при этом свойства окислителя. Свинец в степени окисления +4 может только присоединять электроны, поэтому проявляет только свойства окислителя, олово в степени окисления +2 может и отдавать, и присоединять по два электрона, проявляя при этом свойства или восстановителя, или окислителя.
а) Реакция SnCl2 с НgCl2
SnCl2 +2НgCl2 = SnCl4 + Hg2Cl2
Уравнения электронного баланса:

Sn2+ + 2Hg2+ = Sn4+ + 2Hg+
б) Реакция РЬО2 с НСl (конц.).
РЬО2 + 4НСl (конц.) = PbCl2 + Cl2 + 2H2O
Уравнения электронного баланса:
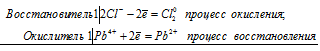
Pb4+ + 2Cl- = Pb2+ + Cl20
Молекулярное уравнение реакции:
РЬО2 + 4НСl (конц.) =
= PbCl2 + Cl2 + 2H2O
Задание 367.
Какие оксиды и гидроксиды образуют олово и свинец? Как изменяются их кислотно-основные и окислительно-восстановительные свойства в зависимости от степени окисления элементов? Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия раствора гидроксида натрия: а) с оловом; б) с гидроксидом свинца (II).
Решение:
Олово и свинец образуют оксиды и диоксиды: PbO, PbO2, SnO, SnO2.
SnO и PbO образуют гидроксиды Sn(OH)2 и Pb(OH)2, которые проявляют амфотерные свойства. У Pb(OH)2 преобладают основные свойства, он растворяется только в концентрированном растворе щёлочи. У Sn(OH)2 преобладают кислотные свойства.
Оксидам PbO2 и SnO2 отвечают гидроксиды H2SnO3 и H2PbO3 – слабые кислоты. Причём кислотные свойства их ослабевают в ряду H2SnO3 — H2PbO3. Основные свойства в ряду Sn(OH)2 — Pb(OH)2 усиливаются.
Уравнения реакции взаимодействия раствора гидроксида натрия: а) с оловом; б) с гидроксидом свинца (II):
а)
Sn +2NaOH + 4H2O =
= Na2[Sn(OH)6] + 2H2↑ (молекулярная форма);
Sn + 2OH– + 4H2O =
= [Sn(OH)6]2- + 2H2↑ (ионно-молекулярная форма).
б)
Pb(OH)2 + 2NaOH =
= Na2[Pb(OH)4] (молекулярная форма);
Pb(OH)2 + 2OH- =
= [Pb(OH)4]2- (ионно-молекулярная форма).

