Характеристика химических свойств кальция
Задание 337
Какое свойство кальция позволяет применять его в металлотермии для получения некоторых металлов из их соединений? Составьте электронные и молекулярные уравнения реакций кальция: а) с V2O5; б) СаSO4. В каждой из этих реакций окислитель восстанавливается максимально, приобретая низшую степень окисления.
Решение:
Благодаря большому отрицательному значению  G0298(СаО) = -604,2 кДж/моль возможно, что кальций способен вытеснять некоторые металлы из их оксидов. Этот метод позволяет применять кальций для получения металлов из их оксидов при действии высокой температуры.
G0298(СаО) = -604,2 кДж/моль возможно, что кальций способен вытеснять некоторые металлы из их оксидов. Этот метод позволяет применять кальций для получения металлов из их оксидов при действии высокой температуры.
Уравнения реакций кальция:
а) Са + V2O5 = СаО + V
Уравнения электронного баланса:
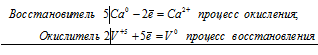
5Ca0 + 2V+5 = 5Ca2+ + 2V0
5Са + V2O5 = 5СаО + 2V
б) Ca + СаSO4 = CaO + CaS
Уравнения электронного баланса:
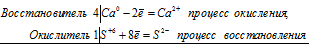
4Ca0 + S+6 = 4Ca2+ + S2-
4Са + CaSO4 = 4СаО + CaS
Задание 338.
Какие соединения называют негашеной и гашеной известью? Составьте уравнения реакций их получения. Какое соединение образуется при прокаливании негашеной извести с углем? Что является окислителем и восстановителем в последней реакции? Составьте электронные и молекулярные уравнения.
Решение:
СаО – оксид кальция называют «негашеная известь». Са(ОН)2 – гидроксид кальция называют «гашённая известь».
а) Оксид кальция получают при термическом разложении известняка СаСО3:
СаСО3(К) СаО(К) + СО2(г)
Этот процесс протекает при температуре 1000 0С (промышленный метод получения СаО).
б) При спекании известняка и графита получают оксид кальция:
С(графит) + СаСО3(К) = СаО(к) + СО(г)
Гашённую известь получают при действии воды на оксид кальция:
СаО + Н2О = Са(ОН)2
При прокаливании негашеной извести с углём образуется карбид кальция:
СаО + 3С СаС2 + СО
Уравнения электронного баланса:
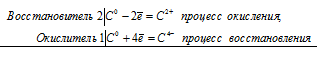
2Ca0 + С0 = 2Ca2+ + С4-
Таким образом, углерод является и окислителем, и восстановителем в данной реакции. Эта реакция является реакцией самоокисления-самовосстановления (реакцией диспропорционирования, дисмутации), потому что протекает с одновременным уменьшением и увеличением степени окисления одного и того же элемента (С – уголь).
Задание 339.
Составьте электронные и молекулярные уравнения реакций: а) кальция с водой; б) магния с азотной кислотой, учитывая, что окислитель приобретает низшую степень окисления.
Решение:
а) Са + Н2О = Са(ОН)2 +Н2↑
Уравнения электронного баланса:
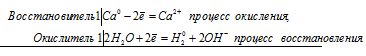
Ca0 + 2Н2О = Ca2+ + 2ОН– + Н20↑
б) 4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3 + 3H2O
Уравнения электронного баланса:
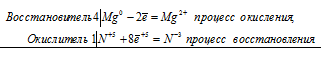
4Mg0 + N+5 = 4Mg2+ + N-3

