Окислительно-восстановительные процессы в реакциях диспропорционирования
Задача 616.
Среди приведенных превращений указать реакции диспропорционирования:
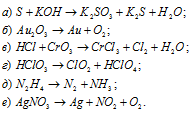
Решение:
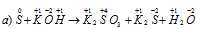
Реакция сопровождается одновременным увеличением и уменьшением степени окисленности атомов одного и того же элемента, первоначально находившегося в одном, определённом состоянии, называется реакцией диспропорционирования (самоокисления-самовосстановления). В данной реакции сера восстанавливается, уменьшая степень окисленности от 0 до -2, а также часть атомов серы, входящих в состав простого вещества S, окисляется, увеличивая свою степень окисленности от 0 до +4.
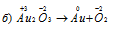
В данной реакции атомы, изменяющие свои степени окисленности, находятся в одной молекуле Au2O3, так атом золота уменьшает свою степень окисленности от +3 до 0, проявляя свойства окислителя, атом кислорода проявляет свойства восстановителя, увеличивает свою степень окисленности от -2 до 0, значит, реакция является внутримолекулярной окислительно-восстановительной.
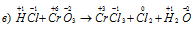
Атом хрома уменьшает свою степень окисленности от +6 до +3, проявляя свойства окислителя, а атом хлора увеличивает свою степень окисленности от -1 до 0, проявляя свойства восстановителя. Реакция характеризуется тем, что атомы, изменяющие свои степени окисленности, находятся в молекулах разных веществ, значит, реакция является межмолекулярной окислительно-восстановительной.
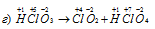
В данной реакции при разложении HClO3 часть атомов хлора восстанавливается, изменяя степень окисленности от +5 до -1, а другая окисляется от +5 до +7. Реакции, которые сопровождаются одновременным увеличением и уменьшением степени окисленности атомов одного и того же элемента, первоначально находившегося в одном, определённом состоянии, называются реакциями диспропорционирования (самоокисления-самовосстановления).
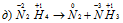
В данной реакции при разложении N2H4 часть атомов азота восстанавливается, изменяя степень окисленности от -2 до -3, а другая окисляется от -2 до 0.
Реакции, которые сопровождаются одновременным увеличением и уменьшением степени окисленности атомов одного и того же элемента, первоначально находившегося в одном, определённом состоянии, называются реакциями диспропорционирования (самоокисления-самовосстановления).
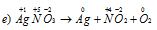
В данной реакции атомы серебра, изменяющие степень окисленности от +1 до 0, принимают электроны, а атомы азота, степень окисленности которых меняется от +5 до +4, их отдают. Реакции, которые характеризуются тем, что атомы, изменяющие свои степени окисленности, находятся в одной и той же молекулярной частице, называются внутримолекулярными окислительно-восстановительными реакциями.
Ответ: а), г), д).
Задача 617.
До каких продуктов может быть окислена вода: а) до 02 и Н+; б) до 0Н- и Н2; в) до 20Н-?
Решение:
Окисление соответствует увеличению степени окисленности элемента, восстановление – её уменьшению. Вещества, содержащие атомы, которые понижают степень окисленности элемента, называются окислителями, а вещества, содержащие атомы, которые степень окисленности повышают – восстановителями. Следовательно, вода может быть окислена, т. е. быть восстановителем, в случае, когда степень окисленности или водорода, или киcлорода может быть повышена. Так как степень окисленности водорода в молекуле Н2О равна её максимальному значению (+1), то водород не может быть восстановителем, а степень окисленности кислорода – низшая (-2), то кислород может быть восстановителем. Исходя из этого, следует, что вода может быть окислена до кислорода со степенью окисленности равной 0, т. е. до О2 и Н+. Что можно представить схемой: 2Н2О – 4 = О2 +4Н+.
= О2 +4Н+.
Процесс восстановления воды идёт по схеме: 2Н2О + 2 = Н2 + 2ОН-. Здесь степень окисленности водорода уменьшается от +1 до 0. Процесс образования из Н2О 2ОН- не протекает.
= Н2 + 2ОН-. Здесь степень окисленности водорода уменьшается от +1 до 0. Процесс образования из Н2О 2ОН- не протекает.
Ответ: а).
Задача 618.
В каких из указанных превращений кислород выполняет функции восстановителя:
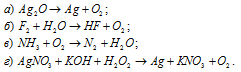
Решение:
Восстановителями являются те элементы, атомы которых повышают степень окисленности. Определим, в каких превращениях кислород повышает свою степень окисленности:
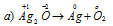
В данной реакции кислород повышает свою степень окисленности от -2 до 0, значит, он является восстановителем.
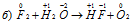
В данной реакции кислород повышает свою степень окисленности от -2 до 0, значит, он является восстановителем
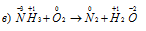
В данной реакции кислород уменьшает свою степень окисленности от 0 до -2, значит, он является окислителем.
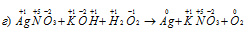
В данной реакции кислород повышает свою степень окисленности от -1 до 0, значит, он является восстановителем.
Ответ: а), б), г).

