Вычисление концентрации ионов водорода и расчет рН раствора электролита
Задача 542.
Во сколько раз концентрация ионов водорода в крови (рН = 7,36) больше, чем в спинномозговой жидкости (рН = 7,53)?
Решение:
а) Определим концентрацию ионов водорода в крови:
pH = -lg[H+] = 7,36,
найдем антилогарифм от величины 7,36. Следовательно, lg[H+]кр = -7,36 = 8,64. По таблице логарифмов находим: [H+] = 4,4 . 10-8 моль/л.
б) Определим концентрацию ионов водорода в спинномозговой жидкости:
pH = -lg[H+] = 7,53,
найдем антилогарифм от величины 7,53. Следовательно, lg[H+]смж = -7,53 = 8,47. По таблице логарифмов находим: [H+] = 3 . 10-8 моль/л.
Находим соотношение концентрации ионов водорода в крови и в спинномозговой жидкости:
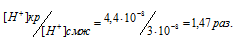
Ответ: в 1,47 раза.
Задача 543.
Определить [H+] и [OH-] в растворе, рН которого равен 6,2.
Решение:
Определим pOH раствора из соотношения:
рН + pOH = 14;
pOH = 14 - рН = 14 - 6,2 = 7,8.
Определим концентрацию ионов водорода:
pH = -lg[H+] = 6,2,
найдем антилогарифм от величины 6,2. Следовательно, lg[H+] = -6,2 = 7,8. По таблице логарифмов находим: [H+] = 6,31 . 10-7 моль/л.
Теперь определим концентрацию ионов [OH-]:
pОH = -lg[OH-] = 7,8,
найдем антилогарифм от величины 7,8. Следовательно, lg[OH-] = -7,8 = 8,2. По таблице логарифмов находим: [OH-] = 1,6 . 10-8 моль/л.
Ответ: [H+] = 6,31 . 10-7 моль/л; [OH-] = 1,6 . 10-8 моль/л.
Задача 544.
Вычислить рН следующих растворов слабых электролитов: а) 0,02 М NH4OH; б) 0,1 М HCN; в) 0,05 н HCOOH; г) 0,01 М CH3COOH.
Решение:
а) KD(NH4OH) = 1,8 . 10-5. Из формулы KD = α2 . Cм, получим:
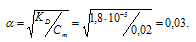
Отсюда
[OH-] = αСм, откуда [OH-] =
= 0,02·0,03 = 6 . 10-4 моль/л;
рОН = -lg[OH-] = -lg6 . 10-4 =
= 4 - lg6 = 4 - 0,78 = 3,22;
рН = 14 - рОН = 14 - 3,22 = 10,78.
б) KD(HCN) = 7,9 . 10-10. Из формулы KD = α2 . Cм, получим:
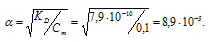
Отсюда
[Н+] = αСм, откуда [Н+] =
= 0,1· (8,9 . 10-5) = 8,9 . 10-6 моль/л;
рН = -lg[Н+] = -lg8,9 . 10-6 =
= 6 - lg8,9 = 6 - 0,95 = 5,05.
в) KD(HCООН) = 1,8 . 10-4. Так как муравьиная кислота одноосновная, то из формулы
K = α2 . Cм рассчитаем степень диссоциации 0,05 М раствора НСООН:
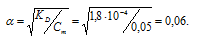
Отсюда
[Н+] = αСм, откуда [Н+] =
= 0,06 · 0,05 = 3 . 10-3 моль/л;
рН = -lg[Н+] = -lg3 . 10-3 =
= 3 - lg3 = 3 - 0,48 - 2,52.
г) KD(СH3CООН) = 1,8 . 10-5. Так как муравьиная кислота одноосновная, то из формулы
K = α2 . Cм рассчитаем степень диссоциации 0,01 М раствора СН3СООН:
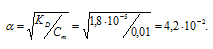
Отсюда
[Н+] = αСм, откуда [Н+] =
= 0,001 · (4,2 . 10-2)5 = 4,2 . 10-4 моль/л;
рН = -lg[Н+] = -lg4,2 . 10-4 =
= 4 - lg4,2 = 4 - 0,62 = 3,38.
Ответ: а) 10,78; б) 5,05; в) 2,52; г) 3,38.

