Сероводород. Водородные соединения серы, селена и теллура
Задача 847.
Объяснить, почему сероводород не осаждает сульфид марганца, но осаждает сульфид меди. Можно ли осадить сульфид марганца из водного раствора его соли?
Решение:
Сульфиды, как электролиты диссоциируют в водных растворах:
МnS ↔ Mn2+ + S2-;
CuS ↔ Cu2+ + S2-.
При пропускании сероводорода через раствор МnS происходит его диссоциация:
H2S ↔2H+ + S2-
Таким образом, в смеси будут присутствовать ионы Mn2+, H+, S2-. Ионы S2- могут участвовать в двух конкурирующих процессах, приводящих к установлению двух равновесий:
S2- + Mn2+ ↔ MnS;
S2- + 2H+ ↔ H2S.
Произведение растворимости МnS равно 7 . 10-17, а суммарная константа диссоциации Н2S (К = К1 . К2 = 6 . 10-22. Так как 7 . 10-17 значительно больше, чем 6 . 10-22, то связывание ионов S2- в молекулы Н2S происходит полнее, чем в молекулы MnS. Поэтому сульфид марганца в присутствии сероводорода будет растворяться.
В растворе сульфида меди в присутствии сероводорода будут присутствовать ионы Сu2+, H+, S2-. Произведение растворимости CuS равно 7 . 10-17, а суммарная константа диссоциации Н2S (К = К1 . К2 = 6 . 10-22. Так как 3,2 . 10-38 значительно меньше, чем 6 . 10-22, то связывание ионов S2- в молекулы СuS происходит полнее, чем в молекулы H2S. Поэтому сульфид меди в присутствии сероводорода не будет растворяться.
Задача 848.
Указать лабораторный способ получения сероводорода. Как можно получить селеноводород и теллуроводород?
Решение:
В лаборатории сероводород можно получить действием на сульфиды металлов, например, на сульфид железа (II) разбавленным раствором соляной кислоты:
FeS + 2HCl ↔ FeCl2 + H2S↑
Селеноводород и теллуроводород тоже можно получить действуя на селениды и теллуриды разбавленными растворами сильных кислот:
К2Se + 2HCl ↔ 2КCl + H2Se;
К2Тe + 2HCl ↔ 2КCl + H2Se.
Задача 849.
Какие водородные соединения образует сера? Как они получаются? Каково их строение? Какие степени окисленности проявляет сера в этих соединениях?
Решение:
В обычных условиях сера с водородом не взаимодействует. Лишь при высокой температуре сера взаимодействует с водородом, образуя сероводород:
H2 + S  H2S
H2S
Cероводород можно получить действием на сульфиды металлов, например, на сульфид железа (II) разбавленным раствором соляной кислоты:
FeS + 2HCl ↔ FeCl2 + H2S↑
В промышленности его получают как обычный продукт при очистке нефти, природного и коксового газа. В природе сероводород содержится в нефти, природном газе, воде минеральных источников. Он выделяется при извержении вулканов и разложения белковых тел.
Достаточно высокой прочностью связи S—S объясняется существование полисульфидов водорода – сульфанов H2S2, H2S3, H2S4 и т. п., а также их солей - полисульфидов. Молекулы сульфанов и полисульфид-ионы имеют цепочечное строение:
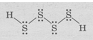
Степень окисления серы в полисульфанах и полисульфидах тем ближе к нулю, чем больше число атомов серы в цепи. Степень окисления серы в сероводороде и сульфидах равна -2.
Задача 850.
Сравнить взаимодействие Sb2S3 с растворами (NH4)2S и (NH4)2S2.
Решение:
При взаимодействии Sb2S3 с растворами (NH4)2S и (NH4)2S2 происходят следующие реакции:
1) При взаимодействии Sb2S3 с раствором (NH4)2S последний растворяется с образованием растворимого комплексного соединения:
Sb2S3 + 3(NH4)2S = 2(NH4)3[SbS3]
тиоантимонит
аммония
2) Для полисульфидов характерны окислительно-восстановительные свойства, поэтому при взаимодействии Sb2S3 с раствором (NH4)2S2 происходят следующая окислительно-восстановительная реакция:
Sb2S3 + (NH4)2S2 = (NH4)2Sb2S5
При этом (Sb3+) увеличивает свою степень с +3 до +4 (Sb5+), т.е. (NH4)2S2 окислитель, а Sb2S3 — восстановитель.

