Как правильно рассчитать массу вещества с использованием коэффициента растворимости
Задача 451.
Сколько граммов нитрата калия выкристаллизуется из 105 г насыщенного при б0 °С раствора, если охладить его до 0 °С? Коэффициенты растворимости соли при указанных температурах соответственно равны 110 и 13 г в 100 г Н2О.
Решение:
Коэффициент растворимости – это масса вещества, растворяющегося при данных условиях в 100 г воды с образованием насыщенного раствора.
Рассчитаем содержание соли при 60 °С из пропорции:
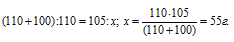
Рассчитаем содержание растворённого нитрата калия при 0 °С из пропорции:
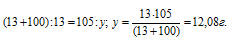
Таким образом, при охлаждении раствора нитрата калия в осадок выпадет 42,92 г соли (55 – 12,08 = 42, 98).
Ответ: 42,98 г.
Задача 452.
1 л воды насыщен СО2 при 0°С под давлением 506,6 кПа (3800 мм рт. ст.). Какой объем займет растворенный газ, если выделить его из воды и привести к нормальным условиям? Растворимость СО2 при 0°С равна 171 мл в 100 мл Н2О.
Решение:
Находим объём газа СО2 при заданных условиях из пропорции:
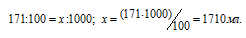
Согласно закону Генри1 масса газа, растворённого при постоянной температуре в данном объёме жидкости, прямо пропорциональна парциальному давлению газа. Следовательно, объём, который будет занимать 1710 мл СО2 при нормальных условиях найдём по уравнению:
V1P1 + V0P0,
где
V1- объём газа при определённом давлении, V2 - объём газа приведенного к нормальным условиям, P1 - давление газа при определённых условиях, P2 - нормальное давление.
Тогда
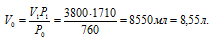
Ответ: 8,55 л.
Задача 453.
Растворимость аммиака при 20 °С равна 702 мл в 1 мл воды. Найти массовую долю аммиака в насыщенном растворе. Парциальное давление NH3 считать равным нормальному атмосферному давлению.
Решение:
Согласно закону Авогадро 1 моль любого газа при нормальных условиях занимает 22,4л.
Рассчитаем массу NH3, содержащуюся в 702 мл раствора из пропорции:
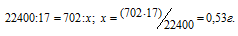
Массовую долю аммиака рассчитаем по формуле:

где
 - массовая доля растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
- массовая доля растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
Тогда
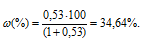
Ответ: 34,64%.
Задача 454.
В 1 л воды при 0 °С растворяется 4,62 л H2S. Под каким давлением надо растворять H2S, чтобы получить 5%-ный (по массе) раствор?
Решение:
Находим массу H2S, растворённого в 1 л воды из пропорции:
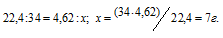
Массовую долю сероводорода рассчитаем по формуле:

где
 - массовая доля растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
- массовая доля растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
Тогда
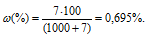
Значит, массовая доля 5%-ного раствора больше исходного в 7,2 раза (5/0,695 = 7,2).
При температуре 0 °С парциальное давление сероводорода равно 101,325 кПа. Известно, что масса газа, растворённого при постоянной температуре в данном объёме жидкости, прямо пропорциональна парциальному давлению газа. Масса газа в 5%-ном растворе будет равна:
Теперь рассчитаем давление, при котором эта масса H2S растворится в 1 л воды из пропорции:
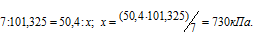
Ответ: 730 кПа.
1Закон Генри — физический закон, согласно которому при постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором. Назван по имени английского химика Уильяма Генри.

