Определение энтальпии растворения вещества, используя удельную теплоемкость раствора
Задача 458.
При растворении 10 г NаОН в 250 г воды температура повысилась на 9,70 °С. Определить энтальпию растворения NаОН, принимая удельную теплоемкость раствора равной 4,18 дж/(г . К).
Решение:
М(NaOH) = 40г/моль. При растворении 10 г NаОН в 250 г воды температура повысилась на 9,70 °С, при этом образуется довольно разбавленный раствор. Общая масса раствора (m) равна 260 г (250 + 10 = 260). По повышению температуры  t) находим количество выделенной теплоты по формуле:
t) находим количество выделенной теплоты по формуле:
Q = cm t,
t,
где
c - удельная теплоёмкость вещества, m - масса раствора,  t - повышение температуры.
t - повышение температуры.
Тогда
Q = 4,18 . 260 . 9,70 =
= 10541,96 Дж или 10,542 кДж.
Изменение энтальпии 10 г щёлочи составляет 10,542 кДж, а мольная масса NaOH - 40 г/моль. Отсюда энтальпия растворения NaOH находим из пропорции:
10 : (-10,542) = 40 : х;
х = [40 . (-10,542)]/10 = - 42,2 кДж/моль.
Ответ: - 42 кДж/моль.
Задача 459.
При растворении одного моля в 800 г воды температура повысилась на 22,4 К. Определить энтальпию растворения H2SO4, принимая удельную теплоемкость раствора равной 3,76 Дж/(г . К).
Решение:
Мольная масса равна 98г/моль. При растворении одного моля кислоты образуется довольно разбавленный раствор, удельная теплоёмкость (с) которого равна 3,76 Дж/(г . К). Общая масса раствора (m)равна 898 г (800 + 98 = 898). По повышению ( t) рассчитаем количество выделенной теплоты по формуле:
t) рассчитаем количество выделенной теплоты по формуле:
Q = cm( t),
t),
где
c - удельная теплоёмкость вещества, m - масса раствора,  t - повышение температуры.
t - повышение температуры.
Тогда
Q = 3,76 . 898 . 22,4 = 75,6 кДж/моль.
Количество выделенной или поглощенной теплоты при растворении 1 моля вещества численно равно энтальпии растворения, причём при выделении теплоты энтальпия принимает отрицательное значение. Тогда энтальпия растворения H2SO4 равна 75,6 кДж/моль.
Ответ: 75,6 кДж/моль.
Задача 460.
Энтальпия растворения NH4NO3 в воде равна  H = 26,7 кДж/моль. На сколько градусов понизится температура при растворении 20 г NH4NO3 в 180 г Н2О, если удельную теплоемкость получающегося раствора принять равной 3,76 Дж/(г . К)?
H = 26,7 кДж/моль. На сколько градусов понизится температура при растворении 20 г NH4NO3 в 180 г Н2О, если удельную теплоемкость получающегося раствора принять равной 3,76 Дж/(г . К)?
Решение:
M(NH4NO3) = 80 г/моль.
Энтальпией растворения вещества называют изменение энтальпии при растворении 1 моля этого вещества в данном растворителе. Энтальпия вещества рассчитывается по формуле:
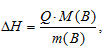
где
Q - количество поглощенной или выделившейся теплоты при растворении вещества, m(B) - масса растворённого вещества, MЭ(В) - мольная масса растворённого вещества.
Рассчитаем количество поглощённой теплоты
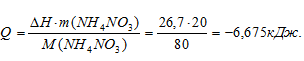
Понижение температуры находим по формуле:
Q = c m  t,
t,
где
c - удельная теплоёмкость вещества, m - масса раствора,  t - повышение температуры.
t - повышение температуры.
Тогда
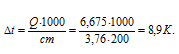
Следовательно, понижение температуры раствора NH4NO3 составляет 8,9 К.
Ответ: 8,9 К.

