Определение энтальпии образования соли, используя энтальпию растворения ее кристаллогидрата
Задача 461.
При растворении 8 г CuSO4 в 192 г воды температура повысилась на 3,95 градуса. Определить энтальпию образования CuSO4 . 5H2O из безводной соли и воды, если известно, что энтальпия растворения кристаллогидрата составляет 11,7 кДж/моль, а удельная теплоемкость раствора равна 4,18 Дж/(г . К).
Решение:
Процесс растворения безводной соли можно представить протекающим в две стадии:
CuSO4 + 5H2O = CuSO4 . 5H2O,  H1;
H1;
CuSO4 . 5H2O + nH2O =
= CuSO4(p-p) + (n + 5)H2O(p-p),  H2.
H2.
Здесь
 H1 - энтальпия образования кристаллогидрата,
H1 - энтальпия образования кристаллогидрата, H2 - энтальпия растворения кристаллогидрата.
H2 - энтальпия растворения кристаллогидрата.
Суммарный процесс выразится уравнением:
CuSO4(к) + (n + 5)H2O(ж) =
= CuSO4(p-p) + (n + 5)H2O(p-p), H3,
H3,
где
 H3 - энтальпия растворения безводной соли.
H3 - энтальпия растворения безводной соли.
Согласно закону Гесса:
 H1 =
H1 =  H3 -
H3 -  H2
H2
Для нахождения искомой величины  H1 нужно вычислить энтальпию растворения безводной соли
H1 нужно вычислить энтальпию растворения безводной соли  H3. Чтобы вычислить
H3. Чтобы вычислить  H3 необходимо рассчитать количство теплоты, которое выделяется при растворении безводной соли по формуле:
H3 необходимо рассчитать количство теплоты, которое выделяется при растворении безводной соли по формуле:
Q = cm t,
t,
где
c - удельная теплоёмкость вещества, m - масса раствора,  t - повышение температуры.
t - повышение температуры.
Тогда
Q = 4,18 . 200 . 3,95 = 3,3 кДж/моль.
Энтальпию растворения безводной соли вычислим по формуле:
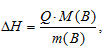
где
Q - количество поглощенной или выделившейся теплоты при растворении вещества, m(B) - масса растворённого вещества, MЭ(В) - мольная масса растворённого вещества.
Тогда
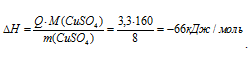
Отсюда
 H1 = (-66) - (11,7) = 77,7 кДж/моль.
H1 = (-66) - (11,7) = 77,7 кДж/моль.
Ответ: -77,7кДж.
Задача 462.
Энтальпия растворения в воде Na2SO4 . 10H2O равна 78,6к,Дж/моль. Рассчитать, на сколько градусов понизится температура при растворении 0,5 моля этой соли в 1000 г воды, принимая удельную теплоемкость раствора равной 4,18Д ж/(г . К).
Решение:
Процесс растворения кристаллогидрата Na2SO4 . 10H2O можно представить уравнением:
Na2SO4 . 10H2O(к) + nH2O =
= Na2SO4(p-p) + (n + 10)H2O(p-p),  H.
H.
Здесь
 H - энтальпия растворения кристаллогидрата.
H - энтальпия растворения кристаллогидрата.
M(Na2SO4 . 10H2O) = 322 г/моль.
Рассчитаем количество теплоты, которое поглощается при растворении 0,5 молей кристаллогидрата по формуле:
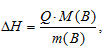
где
Q - количество поглощенной или выделившейся теплоты при растворении вещества, m(B) - масса растворённого вещества, MЭ(В) - мольная масса растворённого вещества.
Тогда
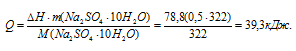
По формуле Q = c m t рассчитаем понижение температуры раствора:
t рассчитаем понижение температуры раствора:
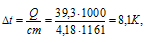
где
c - удельная теплоёмкость вещества, m - масса раствора,  t - повышение температуры, получим:
t - повышение температуры, получим:
m = (0,5 . 322) + 1000 = 1161г.
Ответ: 8,1К.

