Расчет осмотического давления смешанного раствора
Задача 467.
При 25 °С осмотическое давление некоторого водного раствора равно 1,24 МПа. Вычислить осмотическое давление раствора при 0 °С.
Решение:
Так как концентрация раствора – величина постоянная, то, зная осмотическое давление раствора при одной температуре (Т1) можно рассчитать осмотическое давление раствора при температуре (Т2) из соотношения: P1T1 = P2Т2.
Отсюда
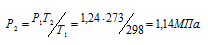
Ответ: 1,14 МПа.
Задача 468.
При 25 °С осмотическое давление раствора, содержащего 2,80 г высокомолекулярного соединения в 200 мл раствора, равно 0,70 кПа. Найти молекулярную массу растворенного вещества.
Решение:
Молярность раствора рассчитаем из формулы: Р = СМRT, где СМ – молярная концентрация, R – газовая постоянная [8,314 Дж/(моль . К)] , T – температура.
Тогда
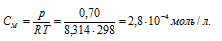
Найдём, сколько граммов высокомолекулярного соединения содержится в 1 л раствора его из пропорции:
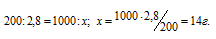
По условию задачи вытекает, что в 1 л раствора содержится 14 г вещества; это составляет 2,8 . 10-4 моля.
Теперь вычислим молекулярную массу соединения по формуле:
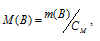
где
М(В) – молекулярная масса вещества, m(B) – масса растворённого вещества, СМ - молярная концентрация.
Тогда
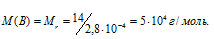
Ответ: Мr(B) = 5 . 104 г/моль.
Задача 469.
При 20 °С смешивают 1 л раствора неэлектролита, осмотическое давление которого 243,4 кПа, с 3 л раствора неэлектролита, осмотическое давление которого 486,8 кПа. Найти осмотическое давление смешанного раствора.
Решение:
Молярности растворов рассчитаем из формулы: Р = СМRT, где СМ – молярная концентрация, R – газовая постоянная [8,314 Дж/(моль . К)] , T – температура.
Тогда
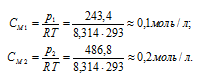
Находим, сколько молей вещества находится в смешенном растворе:
(1 . 0,1) + (3 . 0,2) = 0,7 молей
Теперь рассчитаем молярность раствора после смешения 1 л 0,1М и 3 л 0,2М растворов из пропорции:
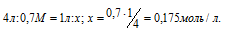
Таким образом, осмотическое давление раствора после смешения равно:
Робщ = 0,175 . 8,314 . 293 кПа.
Ответ: 426 кПа.
Задача 470.
Раствор, в 100 мл которого находится 2,30 г вещества, обладает при 298 К осмотическим давлением, равным 618,5 кПа. Определить молекулярную массу вещества.
Решение:
Молярность раствора рассчитаем из формулы: Р = СМRT, где СМ – молярная концентрация, R – газовая постоянная [8,314 Дж/(моль . К)] , T – температура.
Тогда
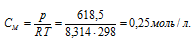
Теперь вычислим молекулярную массу соединения по формуле:
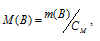
где
М(В) – молекулярная масса вещества, m(B) – масса растворённого вещества, СМ - молярная концентрация.
Тогда
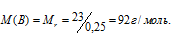
Ответ: Мr(B) = 92 г/моль.

