Приготовление раствора путем растворения вещества в некотором объеме (массе) растворителя
Наиболее часто встречается задача о растворении хлороводорода в воде. При этом необходимо помнить, НСl в обычных условиях — это газ, и к нему применимы газовые законы.
Задача 1.
Концентрация соляной кислоты, полученной растворением 56 л НСl (н.у.) в 2,9 л воды, равна ...% (запишите число с точностью до целых).
Дано:
объем хлороводорода: V(НСl) = 56 л;
объем воды: V(Н2О) = 2,9 л.
Найти: массовую долю НСl в растворе:  (НСl) = ?
(НСl) = ?
Решение:
Использование соотношения для вычисления массовой доли НС1 в соляной кислоте предполагает знание массы НСl и массы раствора.
1. Находим массу НСl. Так как хлороводород является газом и находится при (н.у.) мы можем найти его количество вещества, а затем и массу:
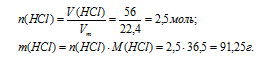
2. Находим массу раствора. Она складывается из массы НСl и массы воды. Массу воды можно определить по ее объему, используя плотность: р(Н2О) = 1 г/мл:
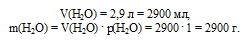
3. Находим массовую долю НС1 в растворе:
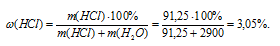
Согласно требованиям условия округляем до целых и получаем ответ: (НСl) = 3%.
Иногда вместо хлороводорода в тестах ЕГЭ для решения задач на приготовление раствора используют следующие газообразные в обычных условиях вещества: NH3; H2S; Н2СО (формальдегид).
Задачи на приготовление раствора:
1. Приготовление раствора хлорида натрия
2. Приготовление 0,25 н раствора серной кислоты
3. Приготовление раствора кристаллогидрата

