"Химия. 9 класс". О.С. Габриелян (гдз)
Сера. Свойства серы и ее соединений
Вопрос 1.
а) сероводород проявляет только восстановительные свойства, так как сера в данном соединении имеет степень окисления —2 наименьшая из возможных степеней окисления серы.
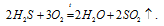
б) оксид серы (ІV) может проявлять свойства, как окислителя, так и восстановителя, т.к. степень окисления серы в данном соединении +4 является промежуточной.
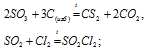
в) сера также может проявлять окислительные и восстановительные способности, т.е. степень окисления серы 0 является промежуточной.
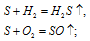
г) серная кислота проявляет окислительные свойства, т.к. степень окисления серы +6 является максимально возможной.
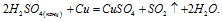
Вопрос 2.
а) Сернистый газ получают при полном сжигании сероводорода и обжиге сульфидов.
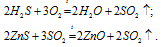
Сернистый газ SO2 — бесцветный газ с характерным запахом, проявляет типичные свойства кислотных оксидов и хорошо растворяется в воде, образуя слабую сернистую кислоту:
SO2 + H2O ↔ H2SO3
Соединения серы (IV): Na2SO3; NaHSO3; SO2 используются для отбеливания шерсти, шелка, бумаги и соломы, а также в качестве консервирующих средств для сохранения свежих плодов и фруктов.
б) Оксид серы (VI) получают по следующей реакции:
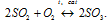
Оксид серы (VI) SO3 — бесцветная, сильно дымящаяся на воздухе жидкость, проявляет типичные кислотные свойства, растворяясь в воле, образует серную кислоту:
SO3 + H2O = H2SO4
Серная кислота — одни из важнейших продуктов, используемых в различных отраслях промышленности.
Вопрос 3.
1) Разбавленная серная кислота выступает в качестве электролита в ионных реакциях. Например,
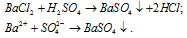
Серная кислота проявляет свойства окислителя. В окислительно – восстановительные реакции серная кислота вступает только концентрированная.
2) Рассмотрим реакции серной кислоты с металлами Zn и Cu с позиции окислительно – восстановительных реакций:
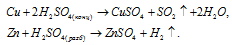
И в том и в другом случае идет ОВР, но в первой реакции роль окислителя играют катионы водорода, а во второй —
серы. Запишем ионное уравнение для второй реакции:
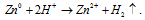
Эту реакцию можно отнести к реакциям ионного обмена. 3) Теперь рассмотрим реакцию ионного обмена с точки зрения теории электролитической диссоциации. Как вы знаете, реакция ионного обмена идет только в том случае, если в результате образуется слабо диссоциирующее вещество. Например,
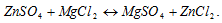
Данная реакция не идет, т.к. не образуются малодиссоциирующие вещества. В растворе находится смесь ионов:
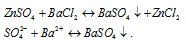
Реакция протекает, потому что сульфат бария — малорастворимое соединение, и выпадает в осадок.
Вопрос 4.
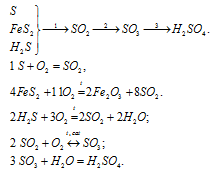
Вопрос 5.
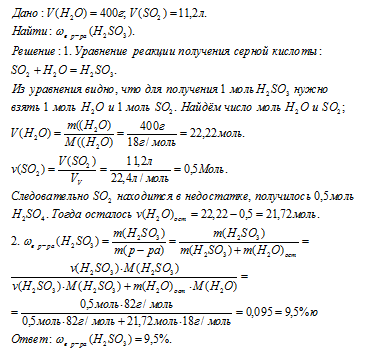
Вопрос 6.
Уравнение реакции синтеза оксида сульфида(VI) имеет вид:
2SO2 + O2 ↔ 2SO3
Данная реакция относится к окислительно-восстановительной:
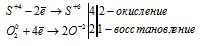
Также реакция синтеза серного газа SO3 является обратимой реакцией, т.е. она идет одновременно в обе стороны. Реакция начинается только при относительно высоких температурах 420-650°С и протекает в присутствие катализатора (платины, оксидов ванадия, железа и т.д.).
Для смещения равновесия вправо, надо согласно принципу Ле Шателье для газов: при высоком давлении реакция идет в ту сторону, где общий объем газов меньше.
В нашем случае слева количество газов З моль, справа — 2 моль, т.е., при увеличении давления реакция будет смещаться в сторону образования SO3.
Вопрос 7.
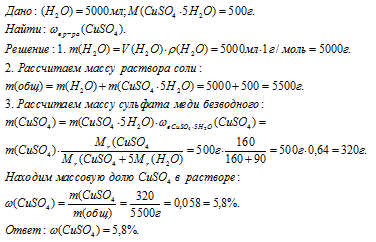
Вопрос 8.
Внимательно рассмотрите схему применения серной кислоты (рис. 25) на стр. 103 и попытайтесь сами ответить на этот вопрос.

