Расчеты по приготовлению растворов веществ
Задача 431.
Найти массу воды, необходимую для приготовления раствора хлорида натрия, содержащего 1,50 моля NaCl на 1000 г Н2О, если имеется 10 г NaCl?
Решение:
Находим массу хлорида натрия, содержащуюся в 1000 граммах воды по формуле:
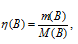
где
n(B) - количество вещества, m(B) - масса вещества, M(B) - молярная масса вещества.
Тогда
m(NaCl) = n(NaCl) . M(NaCl) =
= 1,5 . 58,5 = 87,75 г.
Тогда масса раствора составит: 1000 + 87,75 = 1087,75 г.
Рассчитаем массовую долю хлорида натрия по формуле:
 ,
,
где
 - массовая доля растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
- массовая доля растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
Тогда
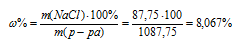
Исходя из того, что для приготовления 8,067%-ного раствора взято 10 г NaCl, можно рассчитать массу раствора:
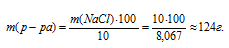
Зная общую массу раствора [m(р-ра) = 124г] и массу вещества [m(B) = 10г], находим массу воды:
m(р-ра) = m(B) + m(растворителя);
m(Н2О) = m(p-pa - m(NaCl) =
= 124 - 10 = 114 г.
Ответ: 114 г.
Задача 432.
Какой бъем 2 н. раствора H2SO4 потребуется для приготовления 500 мл 0,5 н. раствора?
Решение:
Определим молярную массу эквивалента H2SO4 из соотношения:
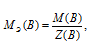
где
MЭ(В) - молярная масса эквивалента кислоты, г/моль; М(В) - молярная масса кислоты; Z(B) - эквивалентное число; Z(кислоты) равно числу ионов Н+, H2SO4 → 2.
Отсюда
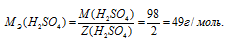
Найдём массу H2SO4 в 500 мл 0,5 н раствора по формуле:
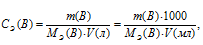
где
m(B)- масса растворённого вещества, MЭ(В) - молярная масса эквивалента растворённого вещества, V – объём раствора (в л или мл).
Тогда
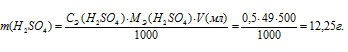
Рассчитаем, какой объём 2 н. раствора H2SO4 потребуется для приготовления 500 мл 0,5 н, используя выше приведённое уравнение, получим:
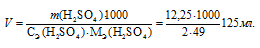
Ответ: 125 мл.
Задача 433.
Какой объем 0,05 н. раствора можно получить из 100 мл 1 н. раствора?
Решение:
Количество эквивалентов вещества в исходном растворе будет равно 0,1 (1 . 100 = 0,1). Обозначим общий объём раствора как (0,1 + х). Тогда количество эквивалентов в полученном растворе можно записать как 0,05(0,1 + х). Поскольку общее количество эквивалентов вещества равно 0,1, то можно записать: 0,05(0,1 + х) = 0,1. Тогда расчетное значение x, получим: 0,005 + 0,05х = 0,1; х = 1,9. Значит, из 100 мл 1 н раствора можно получить 2 литра 0,05 н раствора (0,1л + 1,9 л = 2л).
Ответ: 2л.
Задача 434.
Какой объем 2 М раствора Na2CO3 надо взять для приготовления 1 л 0,25 н раствора?
Решение:
Обозначим нужный объём 2 М раствора через х. Тогда общее количество молей Na2CO3 будет составлять 2х. Учитывая, что эквивалентная масса Na2CO3 в 2 раза меньше молярной, то общее количество эквивалентов вещества можно записать как 2 . 2 = [4]. Поскольку общее количество эквивалентов Na2CO3 в растворе должно быть равно 0,25, то можно записать:
4x - 0,25
Тогда
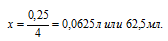
Ответ: 62,5 мл.

