Расчеты энергии активации реакции по уравнению Аррениуса
Задача 341.
Чему равна энергия активации реакции, если при повышении температуры от 290 до 300 К скорость ее увеличится в 2 раза?
Решение:
Из уравнения Аррениуса 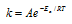 находим:
находим:
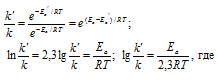
Ea - энергия активации, k и k' - константы скорости реакции, Т – температура в К (298). Учитывая, что происходит повышение температуры реакции от 290 К до 300 К, уравнение можно преобразовать, получим:
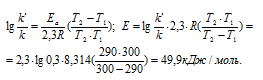
Ответ: 49,9 кДж/моль.
Задача 342.
Каково значение энергии активации реакции, скорость которой при 300 К в 10 раз больше, чем при 280 К?
Решение:
Из уравнения Аррениуса 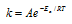 находим:
находим:
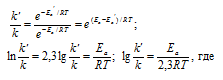
Ea - энергия активации, k и k' - константы скорости реакции, Т – температура в К (298). Учитывая зависимость константы скорости реакции от изменения температуры, получим:
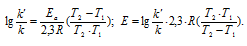
Подставляя в последнее уравнение данные задачи и, выражая энергию активации в джоулях, получим:
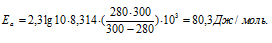
Ответ: 80,3кДж/моль.
Задача 343.
Энергия активации реакции O3(г) + NO(г) → O2(г) + NO2(г) равна 10 кДж/моль. Во сколько раз изменится скорость реакции при повышении температуры от 27 до 37 °С?
Решение:
Из уравнения Аррениуса 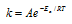 находим:
находим:
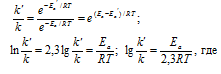
Ea - энергия активации, k и k' - константы скорости реакции, Т – температура в К (298). Учитывая зависимость константы скорости реакции от изменения температуры, получим:
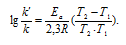
Подставляя в последнее уравнение данные задачи и, выражая энергию активации в джоулях, получим:
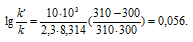
Окончательно находим: k/k' = 1,14.
Ответ: В 1,14 раз.
Задача 344.
Зависит ли температурный коэффициент скорости реакции от значения энергии активации? Ответ обосновать.
Решение:
Согласно правилу Вант-Гоффа, зависимость скорости реакции от температуры определяется уравнением:
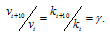
Здесь vt и kt - скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); 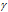 - температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 - 4 (правило Вант-Гоффа).
- температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 - 4 (правило Вант-Гоффа).
Возрастание скорости реакции с ростом температуры принято характеризовать температурным коэффициентом скорости реакции 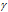 - числом, показывающим, во сколько раз возрастёт скорость данной реакции при повышении температуры системы на 10 градусов. Температурный коэффициент различных реакций различен. В то же время каждая реакция характеризуется определённым барьером энергии; для его преодоления необходима энергия активации – избыточная энергия, которой должны обладать молекулы при данной температуре, для того чтобы их столкновение привело бы к образованию нового вещества. Зависимость константы скорости реакции (k) от энергиия активации (Ea кДж/моль) выражается уравнением Аррениуса:
- числом, показывающим, во сколько раз возрастёт скорость данной реакции при повышении температуры системы на 10 градусов. Температурный коэффициент различных реакций различен. В то же время каждая реакция характеризуется определённым барьером энергии; для его преодоления необходима энергия активации – избыточная энергия, которой должны обладать молекулы при данной температуре, для того чтобы их столкновение привело бы к образованию нового вещества. Зависимость константы скорости реакции (k) от энергиия активации (Ea кДж/моль) выражается уравнением Аррениуса: 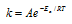 или
или 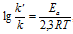 , где
, где
Еа - энергия активации, k и k' - константы скорости реакции, Т – температура в К (298). Учитывая зависимость константы скорости реакции от изменения температуры, получим:
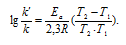
Из чего следует, что чем меньше энергия активации и выше температура, тем больше константа скорости реакции и k'/k .
В стандартных условиях энергия активации различных реакций различна и она зависит от природы реагирующих веществ.
Таким образом, температурный коэффициент (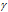 ) не зависит от энергия активации (Ea).
) не зависит от энергия активации (Ea).
Задача 345.
Зависит ли значение энергии активации реакции в случае гетерогенного катализа от площади поверхности катализатора и от ее структуры?
Решение:
Известно, что катализатор снижает энергию активации реакции, чем дольше активность катализатора, тем большее снижение энергии активации реакции наблюдается в присутствии катализатора.
При гетерогенном катализе реакция протекает на поверхности катализатора. Отсюда следует, что активность катализатора зависит от величины поверхности (площади) его и свойств этой поверхности. Чаще всего используют пористую структуру (пемза, асбест и др.). Чтобы увеличить активность данного катализатора, нужно увеличить площадь соприкосновения его с реагентом. Применяют катализаторы с различной структурой поверхности (пористую, порошковую, в виде колец, трубок и т.п.).
Таким образом, с увеличением площади поверхности твёрдого катализатора увеличивается его активность и, соответственно, значительно уменьшается энергия активация катализируемой реакции.
Задача 346.
Реакция 2Н2(г) + О2(г) = 2Н2О(г) протекает с выделением теплоты. Однако для того, чтобы реакция началась, исходную смесь газов надо нагреть. Как это объяснить?
Решение:
Данная реакция является экзотермической, но для начала протекания реакции необходимо дополнительно подогреть смесь водорода и кислорода. Это можно объяснить тем, что энергия активации реакции слишком велика ( больше 120 кДж/моль), значит лишь только малая часть столкновений молекул водорода и кислорода друг с другом приводит к их взаимодействию. Для того чтобы увеличить число активных столкновений необходимо исходную смесь нагреть, т.е. повысить температуру системы, что вызовет разрыв или ослабление связей между атомами молекул газов. При нагревании смеси Н2 и О2 в отношении 2 : 1 происходит взрыв. Объясняется это тем, что из атомов водорода и кислорода, изначально образовавшихся при подогревании газовой смеси, образуются радикалы *ОН, которые легко реагируют с молекулой Н2 с образованием молекул Н2О и *Н. Последний реагирует с молекулой О2 с образованием радикалов *О*, и *ОН. В свою очередь, атом кислорода, реагируя с молекулой Н2, порождает радикалы *Н и *ОН, при столкновении которых образуется молекула Н2О.
Таким образом, при нагревании смеси водорода и кислорода происходит увеличение образования активных частиц(*О*, *Н, *ОН), что порождает цепную реакцию, и скорость её резко возрастает, происходит взрыв смеси газов.

