Цепные реакции. Реакции галогенов друг с другом
Задача 812.
Составить схему цепной реакции хлора с водородом. Какую роль в ней играет освещение? Имеет ли значение частота света?
Решение:
Синтез HCl из Н2 и Cl2 протекает на свету:
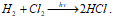
Эта реакция относится к неразветвлённым цепным реакциям. Поглощение кванта света или другой лучистой энергии (hv) молекулой Cl2 приводит к её возбуждению – к появлению в ней энергичных колебаний атомов. И, как только энергия колебаний атомов превышает энергию связи между атомами, то молекула распадается. Формирование цепи начинается с образования радикалов:
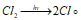
Образующиеся атомы хлора легко реагируют с молекулой водорода с образованием молекулы хлороводорода и атома водорода:
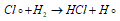
Атом водорода, в свою очередь, легко реагирует с молекулой хлора с образованием молекулы хлороводорода и атома хлора:
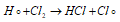
Эта последовательность процесса продолжается дальше, в рассматриваемом случае число звеньев может достигать 100000. При данной фотохимической реакции частота света играет существенную роль, поскольку количество энергии кванта света определяется произведением постоянной Планка (h) и частотой света (v), получим: (hv). От численного значения частоты света зависит величина количества энергии кванта. Для распада молекулы Cl2 на 2 необходима частота света чуть больше 550 ммк. Под действием получаемого при данной частоте кванта света разрушается связь Cl — Cl, а не Н — Н, так как Е(Cl — Cl) = 243 кДж/моль, а Е(Н — Н) = 436 кДж/моль.
Таким образом, под действием света энергии кванта света (Е = hv) достаточно только для разрыва связей Cl — Cl в молекуле Cl2, а не для разрыва связей Н — Н в молекуле Н2. Именно свет является фактором, который определяет начало цепной реакции - образование свободных атомов хлора.
Задача 813.
Написать уравнения реакций взаимодействия галогенов с водой и растворами щелочей (холодными и горячими).
Решение:
а) Уравнения реакций взаимодействия галогенов с водой:
Br2 + H2O ↔ HBr + HOBr
Раствор брома в воде называют «бромной водой».
б) Уравнения реакций взаимодействия галогенов с холодным раствором щёлочи:
Cl2 + 2KOH ↔ KCl + KOCl + H2O;
Cl2 + 2OH- ↔ Cl- + OCl- + H2O.
в) Уравнения реакции взаимодействия галогена с горячим раствором щёлочи:
3Cl2 + 6KOH ↔ 5KCl + KOCl3 + 3H2O;
3Cl2 + 6OH- ↔ 5Cl- + OCl3- + 3H2O.
Таким образом, при растворении галогенов в холодной воде и в холодных растворах щелочей происходит восстановление хлора до степени окисления его атома +1 и окисление галогена до степени окисления -1. В горячих растворах щелочей галоген самоокисляется и самовосстанавливается соответственно до степени окисления -1 и до степени окисления +5.
Задача 814.
Привести примеры возможных реакций галогенов друг с другом. Указать степени окисленности галогенов в продуктах реакций.
Решение:
Известны соединения галогенов друг с другом (галоиды), например: BrCl, ICl3, BrF5, IF7, ClF, ClF5 IBr и другие. Все соединения галоидов могут быть получены прямым синтезом, например:
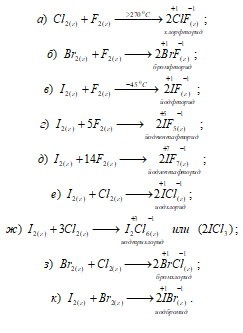
Некоторые из галоидов могут существовать в обычных условиях и не разлагаться, например ClF (газ), BrF (жидкость), IF5 (жидкость), IF7 (газ).
Задача 815.
При 300 °С степень термической диссоциации НI составляет 20%. Каковы при этой температуре равновесные концентрации Н2 и I2 в системе
Н2 +12 ↔ 2НI, если равновесная концентрация НI равна 0,96 моль/л?
Решение:
Обозначим начальную концентрацию HI через х (моль/л). Если к моменту наступления равновесия из каждых х молей йодоводорода диссоциировано х молей,
то при этом, согласно уравнению реакции, образовалось 0,5х; моля Н2 и 0,5х моля I2.
Находим начальную концентрацию HI (х) с учетом того, что термическая диссоциация ее составляет 20% (0,2), составив соотношение:
0,96 = х - (0,96 . 0,2);
х = 0,96 + 0,192 = 1,152 моля.
Тогда равновесные концентрации Н2 и I2 с учётом того, что степень термической диссоциации НI составляет 20%, получим:
[H2] =[I2] = 0,5x . 0,2 = 0,5 . 1,152 . 0,2 = 0,1152 моля.
Ответ: 0,1152 моля.

