Как построить схематическое изображение энергетической диаграммы реакции
Задача 347.
Схематически изобразить энергетическую диаграмму экзотермической реакции А + В ↔ АВ. Какая реакция - прямая или обратная - характеризуется большей константой скорости?
Решение:
Уравнение реакции имеет вид: А + В ↔ АВ. Поскольку реакция экзотермическая, то и конечному состоянию системы (вещество АВ) должен отвечать менее высокий уровень энергии, чем исходным веществам (вещества А и В).
Разность энергий активации прямой и обратной реакций равна тепловому эффекту:  H = Ea(Пр.) - Еа(Обр.). Данная реакция протекает с выделением теплоты, т.е. является экзотермической,
H = Ea(Пр.) - Еа(Обр.). Данная реакция протекает с выделением теплоты, т.е. является экзотермической,  < 0. Исходя из этого, энергия активации прямой реакции имеет меньшее значение, чем энергия активации обратной реакции:
< 0. Исходя из этого, энергия активации прямой реакции имеет меньшее значение, чем энергия активации обратной реакции:
Ea(Пр.) < Еа(Обр.).
На графике видно, что энергия активации прямой реакции меньше, чем энергия активации обратной реакции.
Энергетическую диаграмму экзотермической реакции А + В ↔ АВ:
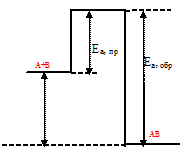
Как следует из уравнения Аррениуса, константа скорости реакции тем больше, чем меньше энергия активации. Поэтому прямая реакция, как реакция с меньшим значением энергии активации, характеризуется большей константой скорости, чем обратная реакция - реакция с меньшим значением энергии активации.
Ответ: k(Пр.) > k(Обр.).
Задача 348.
Схематически изобразить энергетическую диаграмму следующих превращений: 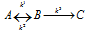 ,
,
если k1 > k2 > k3, а для системы в целом  H > 0.
H > 0.
Решение:
По условию задачи 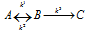 , если k1 > k2 > k3,
, если k1 > k2 > k3,  H > 0.
H > 0.
Энергетическая схема реакции А↔В→С имеет вид:
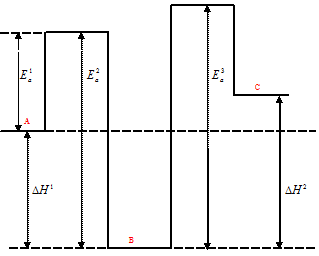
Поскольку константа скорости прямой реакции k1, больше константы скорости обратной реакции k2, то энергия активации прямой реакции должна быть меньше энергии активации обратной реакции
(Еа(Пр.) < Eа(Обр.). Это означает, что в результате превращения вещества сдается второй стадии реакции – (В→С), где k2 > k3, то энергетический барьер для данного процесса будет повышаться (Ea3 > Ea2 ). В соответствии с этими данными, максимум энергии на участке ВС должен быть более высоким, чем на участке ВА. Учитывая, что, по условию задачи для реакции в целом  H > 0, то максимум энергии должен быть ещё больше, чем в начале реакции, т.е. энергетический барьер для процесса ВС должен быть больше, чем для процесса АВ. Что и показано на энергетической диаграмме. В целом процесс эндотермичен.
H > 0, то максимум энергии должен быть ещё больше, чем в начале реакции, т.е. энергетический барьер для процесса ВС должен быть больше, чем для процесса АВ. Что и показано на энергетической диаграмме. В целом процесс эндотермичен.
H > 0  (H1 <
(H1 <  H2).
H2).
Цепные реакции
Задача 349.
Почему в цепной реакции Н2 + Сl2 ↔ 2НС1 зарождение цепи начинается с радикала Cl*, а не с радикала H*?
Решение:
Цепные реакции протекают с участием активных центров – атомов, ионов или радикалов – частиц, обладающих неспаренными электронами и поэтому являющимися высоко реакционными (активными).
В реакции Н2 + С12 ↔ 2НСl происходят следующие процессы:
а) поглощение кванта лучистой энергии (hv) молекулой хлора приводит к её возбуждению – появлению в ней энергичных колебаний атомов, что приводит к распаду молекулы хлора на атомы, т.е. происходит фотохимическая реакция:
Cl2 + hv ↔ Cl* .
б) Образовавшиеся атомы хлора (радикалы) Cl* атакуют молекулы водорода, и при этом образуются молекула НCl и атом водорода H*:
Cl* + H2 ↔ HCl + H*
в) Атом водорода атакует молекулу хлора, и при этом образуются молекула НCl и атом хлора Cl*:
H* + Cl2 ↔ HCl + Cl*
Таким образом, данная реакция является цепной фотохимической, и процесс зарождения радикалов первой цепи реакции начинается с образования радикала Cl*, который образуется при облучении молекулы хлора лучистой энергией. Поглощение кванта света или лучистой энергии (hv) молекулой водорода не происходит, потому что энергия кванта недостаточна для разрыва связи между атомами водорода, так как связь Н—Н прочнее,
чем связь Cl—Cl.

